



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
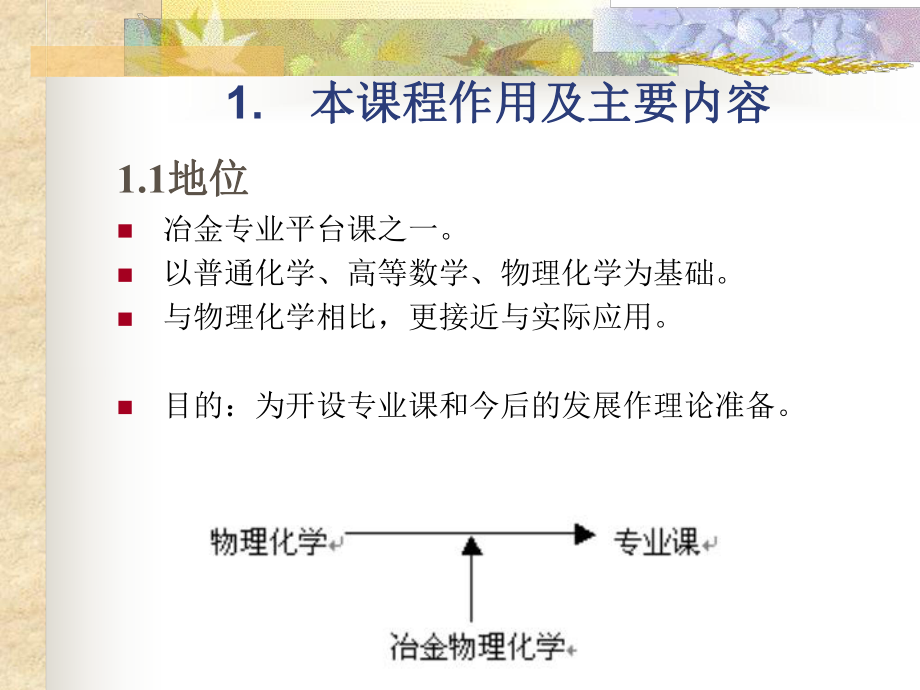
1、參考書目參考書目1.梁連科,冶金熱力學及動力學,東北工學院出版社,19892.黃希祜,鋼鐵冶金原理(修訂版),冶金工業出版社,19903.傅崇說,有色冶金原理(修訂版),冶金工業出版社,19934.車蔭昌,冶金熱力學,東北工學院出版社,19895.魏壽昆,冶金過程熱力學,上海科學技術出版社,19806.韓其勇,冶金過程熱力學,冶金工業出版社,19847.陳永民,火法冶金過程物理化學,冶金工業出版社19848.李文超,冶金熱力學,冶金工業出版社,19951.本課程作用及主要內容本課程作用及主要內容1.1地位地位n冶金專業平臺課之一。n以普通化學、高等數學、物理化學為基礎。n與物理化學相比,更接近
2、與實際應用。n目的:為開設專業課和今后的發展作理論準備。 1.本課程作用及主要內容本課程作用及主要內容火法冶金特點:一高三多火法冶金特點:一高三多1.本課程作用及主要內容本課程作用及主要內容1.2作用作用n將物理化學的基本原理及實驗方法應用到冶金過程中,闡明冶金過程的物理化學規律,為控制和強化冶金過程提供理論依據。n為去除某些元素保留某些元素而選擇合適的冶煉條件(溫度、氣氛)。例如煉鋼過程。此類問題將由本課程解決。 1.本課程作用及主要內容本課程作用及主要內容n注意:由于高溫的特點,宏觀測定難度大,微觀就更難,有時只能使用常溫數據外推,誤差較大。n本學科尚在不斷完善發展中。應學會靈活應用,依據
3、冶物化理論,創造有利反應進行條件,抑制不利反應,提出合理工藝流程。 1.本課程作用及主要內容本課程作用及主要內容1.3冶金實例冶金實例1.3.1高爐煉鐵高爐煉鐵(a)爐頂煤氣成分:nN2 、CO、CO2,少量H2、CH4nN250, CO(2025)、CO2(2217)nCO+CO2(4244)nCO為還原劑且屬有毒氣體,希望能夠在爐內100%消耗。n無法實現的原因:存在化學平衡。1.本課程作用及主要內容本課程作用及主要內容1.3冶金實例冶金實例n(b)礦石中含有Fe、Mn、S、P、Al、Mg、Ca等多種元素,但被還原量卻不同:n原因:氧化物穩定性問題n(c)S、P的去除 煉鋼、煉鐵過程分別去
4、除P、Sn原因:反應條件是否適宜。1.本課程作用及主要內容本課程作用及主要內容1.3冶金實例冶金實例1.3.2煉鋼煉鋼n奧氏體不銹鋼冶煉:去C保Cr。n特種冶金(二次精煉)真空脫氣,礦石中含有Fe、Mn、S、P、Al、Mg、Ca等多種元素,但被還原量卻不同。n原因:氧化物穩定性問題。1.本課程作用及主要內容本課程作用及主要內容1.3.3有色冶金有色冶金n煉銅:氧化煉銅:氧化還原還原電解電解n去鐵 Cu2SCu2OCun濕法:電解過程濕法:電解過程,電化學電化學,phph電位圖電位圖n浸出,萃取過程n熔鹽電解等等1.本課程作用及主要內容本課程作用及主要內容1.4主要內容主要內容熱力學熱力學n第一
5、定律:能量守恒,轉化;n第二定律:反應進行的可能性及限度;n第三定律:絕對零度不能達到。1.4.1冶金熱力學冶金熱力學n主要為第二定律 工具:等溫方程式n正向 逆向 平衡n測定n計算(查表)CPK(0) CPABTn估計值n統計熱力學1.本課程作用及主要內容本課程作用及主要內容1.4.2冶金動力學冶金動力學n研究過程的機理(反應機制)和限制環節n提出一系列模型,找出結癥對癥下藥:提高其反應速度或減緩反應速度。1.本課程作用及主要內容本課程作用及主要內容1.4.2冶金動力學冶金動力學n與物理化學的差異:與物理化學的差異:n物化:只是單相中微觀的化學反應,也稱微觀動力學;n冶金動力學:對多相,還伴
6、有傳熱、傳質現象,為宏觀動力學;n一般說來,由于高溫,所以化學反應速度快,多為擴散為限制行環節;n現狀:數據不全,誤差大,模型的適用性差。1.本課程作用及主要內容本課程作用及主要內容2.冶金物理化學的發展冶金物理化學的發展 2.1國外國外n19201932年,黑色冶金中引入物理化學理論;n1920年,P.Oberhoffer(奧伯霍夫)首次發表鋼液中Mn-O平衡問題的論文;n1925年,Farady Society(法拉第學會)在英國倫敦召開煉鋼物理化學學術年會。n1926年,C.H.Herty(赫蒂)在美國發表平爐煉鋼過程中C、S、Mn等元素變化規律論文,且專門領導建立一個研究平爐冶煉過程問
7、題的小組。n1932年,德國R.Schenk發表專著:鋼鐵冶金物理化學導論(Phsical Chemistry of Steel Manufacture Processes)n其他:德國的Korber和Olsen等。2.冶金物理化學的發展冶金物理化學的發展 2.1國外國外冶金物理化學體系冶金物理化學體系:19321958創立創立J.Chipman(啟普曼)啟普曼),逸度和活度理論逸度和活度理論n1926年畢業于加里福尼亞大學,物理學博士;n1932年發表H2O,CO2,CO,CH4的自由能及在冶金學上的意義(密西根大學,研究工程師);n1937年任麻省理工學院教師;n1942年出版1600化學
8、一書;n1948年發表金屬溶液的活度論文,奠定了活度基礎;n1951年出版堿性平爐煉鋼一書。2.冶金物理化學的發展冶金物理化學的發展 nC.Wagner1952年出版合金熱力學提出活度相互作用系數,使活度更加理論化;1958年出版煉鋼中的動力學問題創立較完整的冶金動力學研究體系;nS.Darken1953年出版金屬物理化學,較系統地論述了“冶金動力學及熱力學”問題 2.冶金物理化學的發展冶金物理化學的發展 2.1國內國內n李公達(19051971),湖北人,南開大學畢業。1931年進入美國密歇根大學研究院,師從美國著名學者J.chipman教授,獲冶金工程博士學位。 n1937年發表H2-H2
9、S混合氣體與Fe中S的平衡,論述了鐵液中s的行為。2.冶金物理化學的發展冶金物理化學的發展 2.1國內國內n魏壽昆(1907),天津人,中國科學院院士。德國德累斯頓工科大學工學博士,冶金過程熱力學、活度在冶金中的應用。n在冶金熱力學理論及其應用中獲得多項重大成果。運用活度理論為紅土礦脫鉻、金川礦提鎳、等多反應中金屬的提取和分離工藝奠定了理論基礎。2.冶金物理化學的發展冶金物理化學的發展 2.1國內國內n鄒元爔 (中科院上海冶金研究所) 發表一系列熔體活度測定方法,如測定Cao-SiO2-Al2O3渣系的活度n我國冶金物理化學活度理論研究的先驅,將冶金物理化學對象從鋼鐵冶金、有色冶金延伸到高純金
10、屬和半導體材料冶金; 2.冶金物理化學的發展冶金物理化學的發展 2.1國內國內n陳新民(19121992),有色金屬冶金先驅,研究火法冶金、濕法冶金、氯化冶金及熔體熱力學理論。 n1947年與J.Chipman共同發表H2-H2O混合氣體與Fe液中Cr的平衡2.冶金物理化學的發展冶金物理化學的發展 2.1國內國內n周國治,中國科學院院士,用Gibbs-Duhem方程計算熔體熱力學性質;2.冶金物理化學的發展冶金物理化學的發展 2.1國內國內n王之昌,東北大學教授王之昌,東北大學教授.n主要學術研究:(一)溶液理論和熱力學:首次揭示各類實際多元系的簡單共性,創立了偏簡單溶液理論、類理想溶液模型和
11、類稀溶液模型。(二)聚合物前驅體陶瓷化學:設計并合成一組新的聚硼硅胺前驅體及其Si-B-C-N材料。(三)稀土化學:在國際上首次系統報道稀土氣態配合物(從鈧至镥)的性質規律。n曾獲得中國科學院重大科技成果一等獎和國家教委科技進步(甲類)二等獎等學術獎勵。2.冶金物理化學的發展冶金物理化學的發展 冶金過程涉及多種溶液:高溫冶金過程在熔融的反應介質中進行, 如煉鋼、鋁電解、粗銅的火法精煉等 ; 產物或中間產品為熔融狀態物質,如高爐煉鐵、硫化銅精礦的造锍熔煉等;溶液組成表示方法:物質的量濃度:molm-3; 質量摩爾濃度:molkg-1;摩爾分數:; 質量分數:;質量濃度;kgm-3。容量性質與強度
12、性質1物理化學基礎物理化學基礎 容量性質:innnPTfY, 21,jnPTiinYY,n一、偏摩爾性質一、偏摩爾性質 當組元i的物質的量發生變化時,Y的變化: 容量性質有相應公式:jnPTiinGG,偏摩爾自由能 jnPTiinSS,偏摩爾自由熵 jnPTiinHH,偏摩爾自由焓 1niiidYYdn1物理化學基礎物理化學基礎n一、偏摩爾性質一、偏摩爾性質 注意:n (1)只有容量性質才有YI;n (2)下腳標:恒T、P;n (3)強度性質;n (4)凡是對純物質適用的公式,對YI也適用。G=H-TSGi=Hi-TSidG=-SdT+VdPdGi=-SidT+VidPn (5)最重要:Gi
13、(化學勢)。1物物理理化化學學基基礎礎二、集合公式和二、集合公式和G-D公式公式1 1221niiiiiYnYn YnYnY集合公式: 對1摩爾溶液: 1nmiiiYxYG-D公式:恒T,P下, 1122112200iiiiiin dYn dYndYx dYx dYx dY1niiidYYdn對式 積分可得: 將集合公式微分: 11nniiiiiidYn dYYdn1niiiYnY1物理化學基礎物理化學基礎1物物理理化化學學基基礎礎定義:定溫定壓下,稀溶液中溶劑的蒸氣壓等于 純溶劑的蒸氣壓與摩爾分數的乘積。 *AAAPPxa、拉烏爾定律(Raoults law)定義:稀溶液中,揮發性溶質的平衡
14、分壓與其在 溶液中的摩爾分數成正比。 BBPK xb、亨利定律(Henrys law)K:比例系數。與溶質、溶劑性質有關。BBPK cBBPK b三、基本定律三、基本定律1物物理理化化學學基基礎礎定義:一定溫度下,氣體在金屬中溶解達平衡,該氣體 分壓的平方根與其質量分數表示的溶解度成正比。122()BBwPkwPC、西華特定律(Sieverts law)適用于溶解在金屬中離解為原子的情況;K為平衡常數,隨溫度變化。三、基本定律三、基本定律1物物理理化化學學基基礎礎1定義:在一定溫度和壓力下,溶液中任一組分在全部 濃度范圍內都服從raoults law。*iiiPPxa、理想溶液(Ideal s
15、olution)四、溶液類型四、溶液類型2定義I:I=I*+RTlnxI 3特征: 0V0H0lniixRS0lniixRTG4冶金中遇到的理想溶液 (1) Fe54和Fe56,Fe54O和Fe56O; (2) Au-Pt,Pb-Sn,Au-Ag等,FeO-MnO, FeO-MgO,MgO-NiO等; (3)AgCl-PbCl2,PbCl2-LiCl,AgBr-KBr。1物物理理化化學學基基礎礎b、稀溶液(Weak solution)四、溶液類型四、溶液類型AAAxPP*BCBCkp1特征特征:溶劑化學勢 AAAxRT ln*BBBCRT ln組元B(溶質)的標志化學勢。濃度異,表達式異。 P
16、kRTxRTxCHgBBHBBBln,ln )(B(H)(BPkRTBRTBCgBBB%)(B(%)(%)Bln, ln% %2稀溶液的稀溶液的s-l平衡平衡(凝固點下降) 凝固點:平衡Tm,由相圖析出固相 ,飽和溶解度 (G)*(S)SlAl*AAAPPx(1)壓力對飽和溶解度的影響:以 為例 *Al AlAlAlAsAxRT ln*)()()(*)(發生可逆變化: )()(lsAddAPTAlAxTlAxPlATsAPsAdxxdPPdTTPdTTAA,)(,)(,)(*)(*)(即:(A)1物理化學基礎物理化學基礎APTAlAxTlATsAdxxdPPPA,)(,)(*)(所以, APT
17、AlAAPTAlAxRTxxRTx,)(*,)(lnVPGT(B)所以,(B)式變為: AalAsAdxxRTdPVdPV)()(則 RTVRTVVdPxdAsllAsAA)()(ln而 較小 *)(*)(lAsAAslVVV1物理化學基礎物理化學基礎(2)溫度對溶解度的影響 恒P,(A)式變為 APTAlAlAsAAPTAlAxPlAPsAdxxdTSdTSdxxdTTdTTA,)()(*)(,)(,)(*)(所以, 2*)()(lnRTHRTSSdTxdmsAlAA式中,Hm1mol組元A在溫度T的熔化熱。若CP=0,則 2*lnRTHdTxdAfusA1物理化學基礎物理化學基礎(3)稀溶
18、液凝固點下降及其應用:分兩種情況 ()析出固相純A*(s): AAmxxTTAARTfusHxd12*lnTTRTTHTTRHxmmAfusmAfusA*)11(ln所以, AAfusmxHRTTTln*32)1ln(ln32BBBBAxxxxxxA較小,則 ,而稀溶液 TmT,所以 BAxxlnBAfusmxHRTT*21物理化學基礎物理化學基礎()析出固熔體(b)、(c)圖中l) )()(lAA 恒P、T發生微小變化, )()(lAAdd即 APTAlAxPlAAPTAAxPAdxxdTTdxdxdTTAA,)(,)(,)(,)()(s、l均 AAAxRT ln*所以, )()()()(l
19、nlnlAlAAAxRTdTSxRTdTS移項得: )()(lnAlAAlAxxRTddTSS)()(12)()(lnAlAmxxTTAlARTHxxd1物理化學基礎物理化學基礎若 ,0PCTRTTHTTRHxxmAfusmAfussAlA*)()(11ln)()(*2lnAlAAfusmmxxHRTTTT 與(1)思路同,可得 )()(*2lnBlBAfusxxHRTT()應用估算合金鋼的凝固點 對于合金鋼和碳素鋼中的元素,由于含量低,所以可近似按稀溶液處理。 BBAAABBAMMMBMBMBMBMBx100)(%)%100(%當%B0或MAMB時 1物理化學基礎物理化學基礎%100BMMx
20、BAB式中%B溶質含量,MA、MB分別為溶劑、溶質的摩爾質量。 對于鐵基溶液, %5585. 0BMxBB 純鐵 Tm=1809K,fusH*Fe=15480Jmol-1,式(1-16)及相關數據代入(1-13)式中,Chipman得到如下是: (1-16)BMBkT)%1 (1000式中, llBBBBxxk%0()(每1%合金元素降低鋼液凝固點的估算公式為: BBMkT)1 (1000 MB合金元素的摩爾質量 (1-17)1物理化學基礎物理化學基礎 Chipman根據k值,計算出一些元素每加入1%降低鐵的凝固點數值。故,各種碳素鋼、合金鋼的凝固點近似估算公式為: %1809BTTB式中,T
21、B每1%B元素使Fe凝固點下降的數值; %B合金元素B的質量百分數濃度。 表1.1 各種合金元素的TB KTBKTB合金元素BWAlBCCoCrCuMnChipman1.05.110090.01.71.8 2.61.7新參考數值 0.5 2.710.28.21.71.54.53.8合金元素BMoNiPSSiTi V Chipman1.52.928.040.06.217.01.3 新參考數值1.7 3.646.155.613.613.92.1 1物理化學基礎物理化學基礎 這里的差別主要取決于、l兩相%B、%Bl;再者(1-17)中不是1000,而是981.5 BMBkT)%1 (5 .981例:
22、求1Cr18Ni9Ti奧氏體不銹鋼的凝固點。解:這類鋼成分0.01%C, 18%Cr, 9%Ni,0.8%Ti 依Chipman數據, Tm=1809-1.818+900.01+2.99+170.8=1736K 依新參數 Tm=1809-1.518+820.01+3.69+13.90.8=1738K 兩者差別不大,但有的元素(P、S、Si)兩種數據相差較遠。 1物理化學基礎物理化學基礎一、實際溶液一、實際溶液一、實際溶液III 區:區:組分 i 的蒸氣壓既不服從拉烏爾定律,也不服從亨利定律。 路易斯提出對實際溶液的濃度進行校正, 使之仍然符合拉烏爾定律。即對實際溶液而言: iiixPP* 校正
23、為: iiiixPP* i i 組分的活度系數。 令: iiiax 則有: iiiaPP* ai 組元 i 的活度。 活度可理解為經校正后的濃度或“有效濃度” 。所謂“有效”是指對拉烏爾定律(或亨利定律)有效。 一、實際溶液一、實際溶液二、活度的標準態(2)標標準準態態的的種種類類(a) 以拉烏爾定律為基礎, 以純物質為標準態 (簡稱為 “純物質標準態” ) 此標準態對應于圖 1 中 A 點的狀態; 采用此標準態時,活度用 aR表示,活度系數用 表示; Riiiiiiapxpp* /*iiRippa )/(*iiiixpp 對于給定成分 xi,aR為實際蒸氣壓 pi與標準態壓力*ip之比,而
24、則為實際蒸氣壓 pi與按拉烏爾定律計算的蒸氣壓(iixp *)之比。 的數值反映了實際溶液與拉烏爾定律的偏差; 與 1 差距越大,則與拉烏爾定律的偏差愈大。 aR與 均為無量綱量。 二、活度的標準態 純物質標準態與熱力學中對單組元體系中所用的標準狀態相同,它主要適用于稀溶液中的溶劑和濃溶液。 當 xi 1 時,符合拉烏爾定律,故: 1,iiRixa 飽和溶液中,溶質 i 與純溶質處于平衡狀態,兩者的化學勢相等, 當以純溶質為標準狀態時, 飽和溶液中溶質的活度為 1, 即: 1*xaiRi *1iix 式中 *ix i 的溶解度; *i 飽和時 i 的活度系數。 在飽和時,溶液中 i 的活度系數
25、等于其溶解度的倒數。 二、活度的標準態二、活度的標準態【解】【解】反應的平衡常數: 2COC2COpapK 在同一標準態的情況下,K 不隨活度而變。以純石墨為標準態時,飽和奧氏體中,RaC=1,因此 6 .140)993. 01 (1993. 02K,05.1506643. 01CCC,飽和飽和xaR 利用此平衡常數可求各濃度時的RaC和活度系數C。 例如,當 xC = 0.04507 時, 6 .140)987. 01 (987. 0C2RaK 解得: RaC= 0.532,C = 0.532/0.04507 = 11. 80 二、活度的標準態(b) 以純物質而又服從亨利定律的假想狀態作為標
26、準態(簡稱“假想的純物質標準態” ) 此標準態對應于圖 1 中 H 點的狀態; 采用此標準態時,活度用 aH表示,活度系數用 fH表示; 切線 0H 表示按亨利定律(pi = xikH)計算得到的 pixi關系,斜率為kH。此切線只在很稀的溶液中才與實際的蒸氣壓曲線相重合。 將切線 0H 延長至純 i 的縱坐標,交點為 H。在此交點上, xi = 1,pi = kH H 點所表示的狀態是根據亨利定律計算出來的假想狀態。 對于實際溶液,活度為實際蒸氣壓 pi與上述假想標準態下蒸氣壓 kH之比,活度系數則為其蒸氣壓 pi與亨利定律的計算值(kHxi)之比。 )/(/iHiHiHiHixkpfkpa
27、 二、活度的標準態【例【例 4】 根據圖 1,求以純物質而又服從亨利定律的假想狀態為標準狀態時,i 組分在成份為 xi1時的活度及活度系數 f。 【解】【解】 在上述假想標準狀態下,蒸氣壓為 kH,而根據圖知在成分為 xi1時,實際蒸氣壓為 pi1,故: 二、活度的標準態4】 根據圖 1,求以純物質而又服從亨利定律的假想狀態為標準狀態時,i 組分在成份為 xi1時的活度及活度系數 f。 【解】【解】 在上述假想標準狀態下,蒸氣壓為 kH,而根據圖知在成分為 xi1時,實際蒸氣壓為 pi1,故: HiHikpa/11 111111/(/)/HiiiHiixfaxpkxpk 顯然1Hia值與上述以
28、拉烏爾定律為基礎以純物質為標準狀態下計算的1Ria值不同。 (c)以濃度為 1%(質量)而又服從亨利定律的(假想)狀態為標準態(簡稱 1%標準態) 此標準態對應于圖 2 中 C 點的狀態; 采用此標準態時,活度用 a%表示,活度系數用 f%表示; 當溶液中濃度的單位采用質量百分數%i 時,溶液中 pi與%i 的關系為實線 0DF,而根據亨利定律的計算值為虛線 0E; 當濃度為 1%時,實際狀態為圖 2 中的 D 點,對應的 i 蒸氣壓為PD;符合亨利定律的假想狀態為 C 點,對應的 i 蒸氣壓計算值為 k%; 對于給定成份%i 的溶液, 若 i 的實際蒸氣壓為 pi, 則 i 的活度為pi與
29、k%之比,活度系數為 pi與亨利定律的計算值(k%i)之比: )%/(/%iiiiikpfkpa 二、活度的標準態二、活度的標準態【例【例 5】當以濃度 1%而又服從亨利定律的狀態為標準狀態時,試根據圖 2 求%i 分別為 1%和 2%時 i 的活度及活度系數。 【解】【解】 在濃度為 1%時, %/kpaDi %/kpfDi 在濃度為 2%時, %/kpaFi EFiPPf/ 采用 1%標準狀態時,對于實際濃度為 1%的溶液,其活度不一定為 1。 二、活度的標準態(d) 以濃度為 1m 而又服從亨利定律的假想狀態作為標準態, (簡稱 “1m標準態” ) 此標準態的實質與上述 1%標準態相同,
30、 ; 采用此標準態時,活度用 am表示,活度系數用 fm表示; 對于濃度為 mi的溶液,若 i 的實際蒸氣壓為 pi,則 i 的活度為 pi與 km之比,活度系數為 pi與亨利定律的計算值(kmmi)之比: )/(/imimimimimkpfkpa 此標準態常用于水溶液中的熱力學研究。當溶液濃度極稀時,服從享利定律,即: mia = mi,mif= 1 二、活度的標準態 對于一定成份的溶液,其實際蒸氣壓為一定值,按亨利定律的計算值也一定,而與所選定的標準態無關,即實際蒸氣壓與按亨利定律計算值的比值一定。 對于給定溶液而言,當選定以亨利定律為基礎的標準態時,其活度系數值都相同,而與具體的標準態無
31、關,即: imiiHiffff% 對于以亨利定律為基礎的標準態,當溶液無限稀時,溶質符合亨利定律,其實際蒸氣壓與按亨利定律的計算值相符。 當溶質 i 的濃度0 時,活度系數為 1,活度等于濃度。即: fi = 1 采用假想的純物質標準態時: iHixa 采用 1%標準態時: %iai 采用 1m 標準態時: imima 其他標準態:如濃度為 1a/O 且服從亨利定律的標準態等。 二、活度的標準態二、活度的標準態01 二、活度的標準態65 標準態:純物質,拉烏爾定律基準。濃度表示方法活度活度系數實際溶液的三種范圍的活度及活度系數xi 0 xi 10 xi 11, 1,*iRiiixaPP*/ii
32、RiPPa iRiRiiixaPP/ix00*/iiiiiiHiiRixPxkPPa1/*iiiiiiiRixPxPPPa1/*iiiiiiiiiRixPxPPPa二、活度的標準態 標準態:假想純物質,亨利定律基準。濃度表示方法活度活度系數實際溶液的三種范圍的活度及活度系數xi 0 xi 10 xi 11, 1,iHiHixakPHiHikPa/iHiHiiixaPPf/ix1/iiHiHHiHifxkxkkPa00*/1/iiiiHiiHiHifxkxPkPa1/iiiHiiHHiHifxfkxfkkPa二、活度的標準態 標準態:質量1%溶液,亨利定律基準。濃度表示方法活度活度系數實際溶液的
33、三種范圍的活度及活度系數xi 0 xi 10 xi 0時, x2=0.5處有極大值;物理意義:0,吸熱,x2=0.5處有極大值,對id正偏差。110時, x2=0.5處有極小值;0 逆反應方向自發 G=0 反應平衡 G0 逆反應方向自發; G=0 反應平衡; G0 正反應方向自發。1. 1. 化學反應方向判斷化學反應方向判斷3.4 等溫方程式的應用2. 2. 確定反應條件確定反應條件(氣氛氣氛、溫度、反應器)、溫度、反應器)3.4 等溫方程式的應用2. 2. 確定反應條件確定反應條件(氣氛氣氛、溫度、反應器)、溫度、反應器)3.4 等溫方程式的應用2. 2. 確定反應條件確定反應條件(氣氛氣氛
34、、溫度、反應器)、溫度、反應器)3.4 等溫方程式的應用5212105 . 6232OVOOVPPaaK2152232105 . 6PPaaOVOOV2. 2. 確定反應條件確定反應條件(氣氛、溫度、(氣氛、溫度、反應器反應器)3.4 等溫方程式的應用真空熔煉:分析氧化物在真空中的穩定性。MgO坩堝 剛玉坩堝 3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性u 單種化合物: A將A與環境氣氛構成化學反應:ABC 通過反應的G判斷穩定性。 注意:環境氣氛的影響。 3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物
35、穩定性Ag2CO3(s)Ag2O(s)CO2(g)110,空氣氣氛: G14824 J/molpCO2=0.028%p,G11.23kJ/mol 若使其穩定存在,則需改變 ? pCO2/p0.0095,G03. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性u 兩種化合物的穩定性: A,B構建化學反應:A+CB 通過反應的G判斷穩定性。 注意:限制條件。 3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性原則:統一標準,使參加生成反應的某元素摩爾數相等。 u 通過生成反應的G判斷穩定性。 Ti(s)O2(g)
36、TiO2(s) (1)Mn1/2O2(g)MnO(s) (2)不僅適用于氧化物,還適用于碳、硫、氯、氮等化合物。3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性u 通過分解反應的G(或分解壓)判斷穩定性。 在一定的溫度下,化合物的生成分解反應達到平衡時產生的氣體的分壓。 分解壓數值:)/ln(ln)MeO(O*)MeO(2pPRTKRTGPf2Me(s) + O2 = 2MeO(s)分解壓與溫度關系)/lg()/ln()MeO(O*)MeO(*)MeO()MeO(O22BTApPTBAGRTGpPff【例題例題】3.4 等溫方程式的應用在一般冶煉溫
37、度(8731873K),除Ag2O、Hg2O 等分解壓可達到大氣壓力,絕大多數氧化物的分解壓都很低。某些金屬氧化物的分解壓與溫度的關系 3.4 等溫方程式的應用3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性平衡時:氣相中氧的化學勢 ?u 通過化學勢判斷穩定性。 2Me(s) + O2 = 2MeO(s)/ln(222OOOpPRT)/ln(2O*)MeO(pPRTGf氧勢氧勢一定溫度下,氧化物的氧勢就一定。因此可用于比較化合物穩定性。氧勢圖氧勢圖)/ln(2O*PPRTGf用途:1. 比較穩定性;2. 判斷T反應開始;3. 判斷分解壓T;4. 擴
38、展標尺。注意:標準狀態。 OC氧化生成CO反應的fG*T 線的斜率為負。C氧化生成CO2反應的fG*T 線的斜率約為0。CO氧化生成氧化生成CO2反應的反應的 fG*T線的斜率為正。線的斜率為正。特點特點對于反應 2H2 + O2 2H2O,fG*T 線的斜率為正,但較一般金屬氧化物的fG* T 線的斜率為小。 H2 -H2O線與反應 2COO22CO2 的fG*-T線相交于1083K(810)。高于810,H2的還原能力強于CO。tCO-CO2、H2-H2O反應的fG*-T 直線位置較高,CO、H2只能用來還原位置比其更高的氧化物。 在標準狀態下,如Cu2O、PbO、NiO、CoO、Fe2O
39、3、Fe3O4、FeO、SnO2等。 t2C+O2 = 2CO反應的fG*-T 直線斜率為負,升高溫度時可用C作還原劑還原更多的氧化物,如: 1300K以下 可還原NiO、CaO、Cu2O、PbO、FeO等 13001800KMnO、Cr2O3、ZnO等; 18002300KTiO2、VO、SiO2等; 2300 K以上CaO、MgO、Al2O3等。3.4 等溫方程式的應用氧勢圖氧勢圖3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性u 同種氧化物不同價態化合物的穩定性。 2V(s) + O2 = 2VO(s) (1)4/3V(s) + O2 = 2
40、/3V2O3(s) (2)V(s) + 1/2O2 = VO(s) (1)V(s) + 3/4O2 = 1/2V2O3(s) (2)3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性2V(s) + O2 = 2VO(s) (1)4/3V(s) + O2 = 2/3V2O3(s) (2)整理:2/3V2O3(s)2/3V(s) = 2VO(s) (3)213GGGG注意:有V存在時,VO更穩定。 2000K時,G44.0kJ/mol3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(1)確定化合物穩定性V(s) + 1/2O2 =
41、 VO(s) (1)V(s) + 3/4O2 = 1/2V2O3(s) (2)整理:VO(s) +1/4O2(g) = 1/2V2O3(s) 413)ln(2ppRTGGO注意:有O存在時,誰更穩定與氧分壓高低有關。平衡時:Pa10462Op3. 3. 復雜體系熱力學分析復雜體系熱力學分析3.4 等溫方程式的應用(2)多相化學反應的平衡V2O3(s)3C(S) 2V(s) +3CO(g)結論:在高于1842K條件下,即可還原得到V。計算G0, 吸熱反應 K ;若KJ時,G0。H0, 放熱反應 K ;若K0。2)ln(RTHTKaJRTKRTGlnln)/ln(KJRTGa2.2.改變壓力改變壓
42、力3.5 平衡移動原理的應用對增容反應,減少體系壓力對正向有利;對減容反應,增加體系壓力對正向有利。aJRTKRTGlnln對有非凝聚態物質存在的反應:PPi氣體:3.3.改變活度改變活度3.5 平衡移動原理的應用影響活度的因素:aJRTKRTGlnln對凝聚態物質:iwiHwiixiHxiiiRixfaxfaxa)()()()( %1 :為標態:以以假想純標態:以純物質為標態溫度溫度,壓力壓力1.1.蒸氣壓法蒸氣壓法3.6 活度的實驗測定*/iiRiPPa xiHxikPa/)(wiHwikPa/)(Cd-Sn合金中Cd的分壓(682) 1.1.蒸氣壓法蒸氣壓法3.6 活度的實驗測定2.2.
43、化學平衡法化學平衡法3.6 活度的實驗測定cCOCOapppk221C+CO2(g)=2CO(g)(221pppKaCOCOcRTGKlnSi+2O=(SiO2) 222%22OfSifaaaaKOSiSiOOSiSiO1直接法 2.2.化學平衡法化學平衡法3.6 活度的實驗測定S+H2(g)=H2S(g)2間接法 22SHSHaPPKKPPaHSHS22SSHSHfKfSPPK%22SfKKlogloglog3.3.分配平衡法分配平衡法3.6 活度的實驗測定)()(BAii)()()()(lnlnBiBiAiBiaRTaRT)()(BiAi1)()(BiAiaa一定溫度下,溶質i能溶于互不相
44、溶的A、B兩相并達平衡,若標態選擇相同:若標態選擇不同:)()(BiAiexp)()()()(RTaaLaAiBiBiAiBiAiLa)()(lim0BiAiLalim0分配常數:4.4.電動勢法電動勢法3.6 活度的實驗測定將待測組元參加的反應構成原電池或濃差電池:(Pt)Pb(l)|PbO-SiO2|O2(100kPa),(Pt)Pt(l)+1/2O2=(PbO)PbOaFRTEEln2EE (Pt)Pb(l)|PbO(l)|O2(100kpa),(Pt)RTEEFaPbO)(2ln1.1.化學平衡法化學平衡法3.6G的實驗測定KRTGln測不同T時的K,回歸: BTAKln(1)直接法例
45、:Si(s)+SiO2(s)=2SiO(g)21PPKSiO測得不同溫度下的pSiO(Pa) A和B是待定常數,由不同溫度下的pSiO回歸求得:)/(1057. 32146.17)log(log42KTPPKSiO1.1.化學平衡法化學平衡法3.6 G的實驗測定(2)間接法前:Si(s)+SiO2(s)=2SiO(g) (3)由式3、2可得1,可根據G3、G2求G1 Si(s)+1/2O2= SiO(g) (1) 反應難控制,難免產生SiO2Si(s)+O2(g)=SiO2(s) (2)1.1.化學平衡法化學平衡法3.6 G的實驗測定(2)間接法直接測量困難。 Pa10162OP1000K,平
46、衡 FeO(s)+CO(g)=Fe(s)+CO2(g) (2) CO(g)+1/2O2 (g) =CO2(g) (3) 11lnKRTG12195640molJG由2、3式可求得 1式:Fe(s)+1/2O2=FeO(s) (1)1)1000(156.199molkJGGFeOf采用CO2CO或H2OH2平衡(定組成氣體)來實現。2.2.電化學法電化學法3.6 G的實驗測定nFEG(Pt),Pb(l) |PbO(l)| O2(P),(Pt)Pb(l)+1/2O2=PbO(l)C)1080900(molJ)K/T(03.72185100GO將化學反應設計成原電池,參加反應的物質處標準狀態:3.6
47、 G的實驗測定(Pt)Fe,FeO(s)|ZrO2+CaO|Ni,NiO(s)(Pt) 正極 NiONi+O2- 負極 O2-+FeFeO+2eFEGGNiOfFeOf2FEGGGNiOfFeOf2FEGGGNiOfFeOf2NiOfFeOfGGFEG2FEGGNiOfFeOf22.2.電化學法電化學法電池反應 NiO(s)+Fe(s)Ni(s)+FeO(s)測FeO的標準生成吉布斯自由能3.6 G的實驗測定(Pt)Fe,TiO2,FeOTiO2(s)|ZrO2+CaO|Ni,NiO(s)(Pt) 參比極():NiO+2eNi+O2- 待測極():O2-+Fe+TiO2FeOTiO2 +2e
48、電池反應:NiO2+ Fe+TiO2Ni+FeOTiO2 FEGGGGTiOfNiOfTiOFeOfm222FEGGGGTiOfNiOfTiOFeOfm222FEGGGGTiOfNiOfTiOFeOfm2222.2.電化學法電化學法3.6 G的實驗測定FeO (s) +TiO = FeOTiO2 (s)Fe(s)+1/2O2+TiO2 (s) = FeOTiO2 (s)Fe (s) + Ti (s)+3/2O2 = FeOTiO2 (s)2.2.電化學法電化學法注意:此處求得的 對應下面哪個反應?2TiOFeOfG一、一、基本概念基本概念 1 相圖基礎相圖:相平衡體系的幾何圖示。描述多相體系中
49、相狀態與T、P、x等的關系。凝聚系:沒有或不考慮氣相的體系。自由度:在一定范圍內可以任意獨立改變而不致發生相變化的變數(如溫度、壓力和濃度等)的個數。一、一、基本概念基本概念 1 相圖基礎l相律:多相體系平衡的基本規律。說明平衡體系中相數、獨立組元數與自由度的關系。考慮到溫度、壓力兩個變數時:f=K+2f:自由度; K:獨立組元數; :相數對有其他影響因素的平衡體系,如磁場、電場等:為:f= K+n對于凝聚系,可以不考慮體系壓力:為:f= K+1一、一、基本概念基本概念 1 相圖基礎實例:FeO-Fe-O2系 l 當FeO、Fe是固態時,體系有3相,有一個氧化反應:Fe+1/2O2=FeO,
50、K=3-1=2,自由度 f=2-3+2=1。分解壓是溫度的函數。l 對于鐵液中的FeO、Fe,相數為2,自由度f=2-2+2=2, 影響氧分壓的除了溫度,還有鐵液中FeO的活度。二、二、二元相圖二元相圖 1 相圖基礎2. 基本類型AA+BBLA+LB+L1.簡單共晶型簡單共晶型AA+AmBnLA+LB+L2.具有穩定化合物具有穩定化合物AmBn+BBAmBn(AmBn+L)二、二、二元相圖二元相圖 1 相圖基礎2. 基本類型AA+AmBnLA+LB+L3.具有不穩定化合物具有不穩定化合物AmBn+BBAmBn(AmBn+L)LA+LB+LA+AmBnAmBn+BA+B4.固相分解化合物型固相分
51、解化合物型BA二、二、二元相圖二元相圖 1 相圖基礎2. 基本類型LA+LB+LA+B5.固相晶形轉變固相晶形轉變BAA+BLA+LB+LA+L26.液相分層液相分層BAA+BL1+L2二、二、二元相圖二元相圖 1 相圖基礎2. 基本類型7.連續固溶體型連續固溶體型LABsL+s8.連續固溶體型連續固溶體型LABsL+sLABsL+s二、二、二元相圖二元相圖 1 相圖基礎2. 基本類型AAs+BsBLAs+LBs+L9.有限固溶體型有限固溶體型具有最低共熔點具有最低共熔點BsAsAB10.有限固溶體型有限固溶體型具有轉熔點具有轉熔點+L+L+L二、二、二元相圖二元相圖 1 相圖基礎3. 相變反
52、應類型分解型共晶反應L S1+S2 共析反應S S1+S2 偏晶反應L1 L2+S 熔晶反應S1L+S2 二、二、二元相圖二元相圖 1 相圖基礎4. 相變反應類型合成型包晶反應L+ S1 S2 包析反應 S1+S2 S3 固相合成 A+B Am B n 合晶反應L1+L2S 二、二、二元相圖二元相圖 1 相圖基礎5. 相圖基本原則(1). 相區鄰接原則: 只有相數相差為1的相區方可直接毗鄰。R1R-D-D+0L+A+BL+B(2). 相界線構筑規則: 單相區與兩相區鄰接的界限延長線必進入兩相區。 即:單相區兩邊界線夾角小于180。三元系:l單相區與兩相區鄰接的界限延長線必進入兩個兩相區,或同時
53、進入三相區。 2 鐵氧二元相圖一、讀圖(點、線、面的物理意義)一、讀圖(點、線、面的物理意義)FeO二元相圖是分析鐵的氧化、鐵氧化物還原與分解的基礎特殊線單相區 2 鐵氧二元相圖浮士體:溶解O的FeO相不同溫度下含氧量不同不存在化學計量的FeO表示FexO,xK、T10%當熔渣(wSiO2)為10%30%,考慮對完全離子溶液的偏差:(1)電當量分數:一個n價正離子應相當于n個一價正離子。2222 22ABABABABnnxxnnnn三、三、熔渣模型熔渣模型 1 熔渣理論及模型針對完全離子溶液模型的修正。AX-BX2熔體中:電當量分數通式:kkkAAAknxkn(2)離子反應的平衡商 異號離子間
54、反應相互干擾,對反應有影響;且各自影響程度不同。例,鋼液的脫硫反應:S+(O2-)=(S2-)+O (1)渣中有Ca2+、 Fe2+、 Mn2+、 Mg2+。僅考慮Ca2+、 Fe2+,則可寫成: 22,Ca FeCa FeSOSO三、三、熔渣模型熔渣模型 1 熔渣理論及模型 SCaOCaSO SFeOFeSO22CaFeCaFeGxGxG三、三、熔渣模型熔渣模型 1 熔渣理論及模型對G亦有類似的等式:2222lnlnlnCaFeCaFeCaFeCaFeGxGxGKxKxK 222222OOSSSSSOOOxKKfx 22lnlnlnlnCaFeCaFeKxKxKf一般情況下,lnf()很小,
55、可忽略,故得:lnKlniixK(1)依有關離子反應的平衡實驗,以lnKxi作圖, xi1(xj 0)(2)由已知數據(含離子i化合物單獨參加反應的Gi), Gi=-RTlnKi,若兩者相差不大,表明處理得當。若相差大,說明不可略,用平衡商處理則誤差大。 SOOSxxK22反應中的O2-分別由(CaO)、(FeO)、( MnO)、( MgO)、( Na2O)提供,例如Ward等對含Ca2+、 Fe2+、 Mn2+、 Mg2+、 Na+的渣與鐵中S 反應 S+(O2-)= (S2-) +O,由定義三、三、熔渣模型熔渣模型 1 熔渣理論及模型 42.66 63. 1logK 102.82 55.
56、3logK 101.32 88. 1logK 102.51 60. 1logK 106.45 19. 1logK K Na222-Mg2-Mn2-Fe2-Ca1873OSNaSONaOMgSSMgOOMnSSMnOOFeSSFeOOCaSSCaO22222222 logKlogloglogloglog 1.191.601.883.551.63 CaFeMnMgNaCaFeMnMgNaCaFeMnMgNaxKxKxKxKxKxxxxx 根據S在渣金間的平衡實驗,用logK對xi作圖,外推 至xi1logK= logKi,對logKi進行修正,如logKFe由-1.60 -1.90。三、三、熔渣模
57、型熔渣模型 1 熔渣理論及模型2222log1.41.92.03.5CaFeMnMgKxxxx三、三、熔渣模型熔渣模型 1 熔渣理論及模型假設:(1)氧化物離解為Si2+、Ca2+、O2-等離子;(2)正離子在負離子間隙無規則分布,作用能不等。iERTGHiiln1nnEmmijijij iHGx x 適用于高堿度氧化渣,處理鋼液與渣中S、P分配; 不涉及SixOy的結構問題。三、三、熔渣模型熔渣模型 1 熔渣理論及模型結構相關模型:(1)MOM2+O2-,SiO2+O2-SiO42-聚合;(2)所有硅氧離子聚合反應的K相等;(3)熔體為理想溶液。(正離子、負離子理想溶液)aMO的計算公式:2
58、1112111(1)SiOMOMOxaaK 適用于二元渣系硅酸鹽內aMeO的計算。冶金物理化學 2 熔渣物理化學性質東北大學材料與冶金學院東北大學材料與冶金學院冶金物理化學熔渣中: CaO、MnO、FeO、MgO、CaF2、Fe2O3、A12O3、TiO2、SiO2、P2O5 堿性增強中性(兩性)酸性增強 對于同一種金屬,通常其高價氧化物顯酸性或兩性,而其低價氧化物顯堿性。如Fe、V等。一、一、熔渣堿度(酸度)熔渣堿度(酸度) 2熔渣物理化學性質 堿性氧化物:能供給氧離子O2的氧化物如:CaO、MnO、FeO、MgO、Na2O、TiO等, CaO Ca2+ + O2 酸性氧化物:能吸收O2而形
59、成復合陰離子的氧化物 如:SiO2、P2O5、 V2O5等, SiO2 + 2O2 = SiO42 兩性氧化物:在強酸性渣中可供給O2而呈堿性,而在強堿性 渣中會吸收O2形成復合陰離子而呈酸性的氧化物 如: Al2O3、Fe2O3、Cr2O3、ZnO等, Al2O3 2Al3+ + 3O2Al2O3 + O2 = 2AlO2一、一、熔渣堿度(酸度)熔渣堿度(酸度) 2熔渣物理化學性質冶金中常用的堿度表示方法 (1)質量百分比:2%CaOR=%SiO(2)用xi表示:2CaOSiOxR=x223CaOMgOSiOAl Ox+xR=x+x(3)光學堿度:測O2-活度。離子理論把渣中aO2-的大小作
60、為判斷熔渣酸堿性強弱的標準, 而渣中aO2- 大小由渣中存在的正離子靜電勢大小決定。)(%18. 1%522OPSiOCaOR一、一、熔渣堿度(酸度)熔渣堿度(酸度) 2熔渣物理化學性質堿性氧化物向渣中提供O2,酸性氧化物吸收渣中的自由O2。 堿性氧化物提高a(O2),酸性氧化物降低a(O2) 。 在離子理論中,aO2 大小作為熔渣酸堿性的量度。 aO2越大,則熔渣的堿度越大;反之,熔渣酸度越大。 2熔渣物理化學性質一、一、熔渣堿度(酸度)熔渣堿度(酸度)熔渣aO2 值的大小不表示該渣氧化性的強弱不表示該渣氧化性的強弱。 與熔渣中各種氧化物的數量及種類有關,而熔渣的氧化性只與其中能提供氧的組分
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 歐美文學選讀試題及答案
- 激光實驗室管理試題及答案探索
- 水務部門考試題及答案
- 藥品管理制度總結試題及答案
- 激光技術與傳統工藝對比試題及答案
- 藥品儲存與配發要點試題及答案
- 衛生管理制度構建的重要性試題及答案
- 激光技術考試知識梳理與分析
- 疫情現場測試題及答案
- 藥師職業發展試題及答案
- 河北單招時政試題及答案
- 合理應用抗生素的培訓
- 2025年山東省聊城市冠縣中考一模地理試題(原卷版+解析版)
- 馮姓姓氏歷史起源研究報告
- 使用錯誤評估報告(可用性工程)模版
- 高中英語新課程標準解讀課件
- 干部履歷表(中共中央組織部2015年制)
- 中國特色社會主義理論體系的形成發展PPT2023版毛澤東思想和中國特色社會主義理論體系概論課件
- 喜來登酒店設施及面積分配表
- 商業地產-租金測算表950354217
- 童年歌詞拼音版

評論
0/150
提交評論