



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
1、一、溶液一、溶液考綱解讀:了解溶液的涵義,理解溶液中溶質的質量分數的概念;考綱解讀:了解溶液的涵義,理解溶液中溶質的質量分數的概念;了解飽和溶液、溶解度的概念;了解溫度對溶解度的影響及溶解了解飽和溶液、溶解度的概念;了解溫度對溶解度的影響及溶解度曲線。度曲線。1、溶液的涵義、組成、溶液的涵義、組成(1)溶液的概念:一種或一種以上的物質分散到另一種物質)溶液的概念:一種或一種以上的物質分散到另一種物質里形成里形成均一、穩定均一、穩定的的混合物混合物。(3)形成過程)形成過程溶解溶解(2)組成:)組成: 宏觀:宏觀:由溶質和溶劑組成。由溶質和溶劑組成。 微觀:微觀:由溶質的分子或離子(水合分子或水
2、合離子)由溶質的分子或離子(水合分子或水合離子) 溶劑的分子組成。溶劑的分子組成。NaCl(s) Na +(aq) +Cl+(aq)溶解溶解結晶結晶專題專題7 物質的量濃度物質的量濃度(4)分類:)分類:飽和溶液:在一定溫度下,在一定量的溶劑里,不能再溶解某飽和溶液:在一定溫度下,在一定量的溶劑里,不能再溶解某種溶質的溶液。種溶質的溶液。飽和溶液飽和溶液不飽和溶液不飽和溶液增加溶劑或升高溫度(通常)增加溶劑或升高溫度(通常)增加溶質、減少溶劑或降溫(通常)增加溶質、減少溶劑或降溫(通常)2、溶液的定量表示、溶液的定量表示(1)溶解度()溶解度(S)固體溶解度:在一定固體溶解度:在一定溫度溫度下
3、,某固態物質在下,某固態物質在100 g溶劑里達到溶劑里達到飽和狀態時所溶解的質量。飽和狀態時所溶解的質量。氣體溶解度:某氣體在氣體溶解度:某氣體在101 kPa,一定,一定溫度溫度時溶解在時溶解在1體積水里體積水里達到飽和狀態時的氣體體積。達到飽和狀態時的氣體體積。 依溶解度可將固體物質的溶解性依溶解度可將固體物質的溶解性劃分為劃分為4個范圍:個范圍:00.01(難溶難溶) 0.011(微微) 110(可可) 10以上以上(易易)S 100 =m(溶質溶質) m(溶劑溶劑)物質溶解過程中,使溶液溫度升高的常見物質:濃物質溶解過程中,使溶液溫度升高的常見物質:濃H2SO4、NaOH ;溫度降低
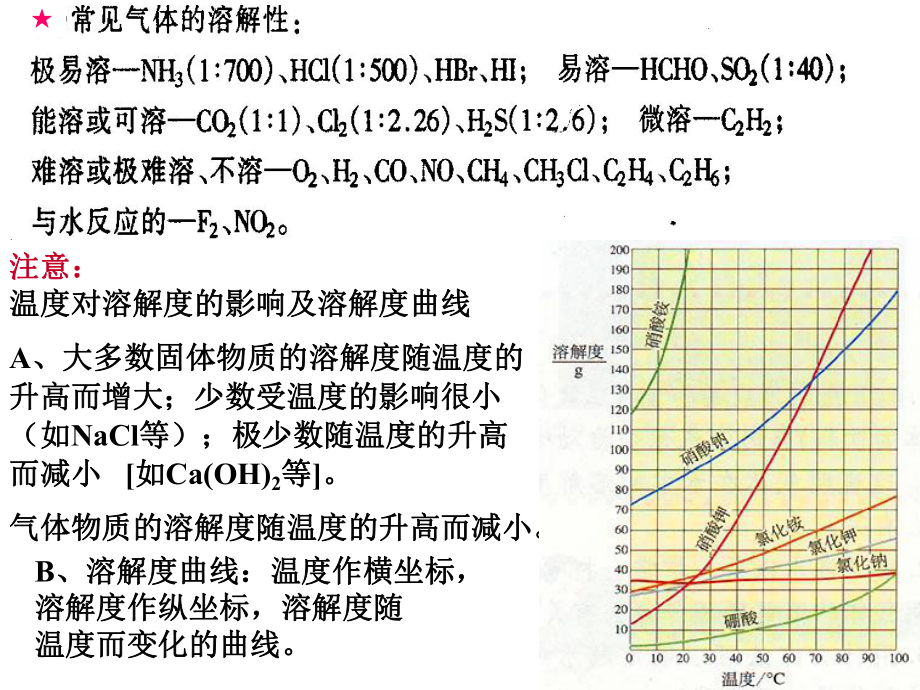
4、的有:溫度降低的有:NH4NO3;溫度基本不變的有:;溫度基本不變的有:NaCl、白糖等。、白糖等。步步高步步高P21注意:注意:溫度對溶解度的影響及溶解度曲線溫度對溶解度的影響及溶解度曲線A、大多數固體物質的溶解度隨溫度的、大多數固體物質的溶解度隨溫度的升高而增大;少數受溫度的影響很小升高而增大;少數受溫度的影響很小(如(如NaCl等);極少數隨溫度的升高等);極少數隨溫度的升高而減小而減小 如如Ca(OH)2等等。氣體物質的溶解度隨溫度的升高而減小。氣體物質的溶解度隨溫度的升高而減小。B、溶解度曲線:溫度作橫坐標,、溶解度曲線:溫度作橫坐標,溶解度作縱坐標,溶解度隨溶解度作縱坐標,溶解度隨
5、溫度而變化的曲線。溫度而變化的曲線。 3、有關計算、有關計算(1)有關溶解度的計算)有關溶解度的計算A.定義法定義法溶劑溶質mm100SB.關系式法關系式法溶質溶質 + 溶劑溶劑 = 飽和溶液飽和溶液a ba + bS100S+100100Sba100bSaC.利用溶解度曲線及溶解度數據進行計算和判斷利用溶解度曲線及溶解度數據進行計算和判斷(2)溶解度與溶質質量分數、溶質物質的量濃度的關系)溶解度與溶質質量分數、溶質物質的量濃度的關系(2)溶質的質量分數)溶質的質量分數)%(100S100S%100mmm%100mmBBBB飽和(溶劑)(溶液)(3)物質的量濃度()物質的量濃度(mol/L))
6、()S100(MS1000M1000Vnc飽和步步高步步高P18討論討論1:甲、乙兩物質的溶解度曲線如圖所示。下列敘述中,甲、乙兩物質的溶解度曲線如圖所示。下列敘述中,正確的是(正確的是( )A. t1時,在時,在100 g 水中放入水中放入60 g甲,其溶質的質量分數為甲,其溶質的質量分數為37.5% B. t1時,甲和乙的飽和溶液的物質的量濃度一定相等時,甲和乙的飽和溶液的物質的量濃度一定相等C. t2時,甲和乙的飽和溶液的溶質的質量分數一定相等時,甲和乙的飽和溶液的溶質的質量分數一定相等D. t2時,分別在時,分別在100 g水中各溶解水中各溶解20 g甲、乙,同時降低溫度,甲、乙,同時
7、降低溫度,甲先達到飽和甲先達到飽和D1020304050溶解度溶解度/gt1t2溫度溫度/ 乙乙甲甲討論討論2:某溫度時,用惰性電極電解硝酸鈉的不飽和溶液。若兩極某溫度時,用惰性電極電解硝酸鈉的不飽和溶液。若兩極收集到的氣體總體積為收集到的氣體總體積為22.4aL時,剩余溶液恢復至原溫度,析時,剩余溶液恢復至原溫度,析出溶質出溶質mg;若兩極收集到的氣體總體積為若兩極收集到的氣體總體積為33.6aL時,剩余溶液時,剩余溶液恢復至原溫度,析出溶質恢復至原溫度,析出溶質ng;則硝酸鈉在該溫度時的溶解度為;則硝酸鈉在該溫度時的溶解度為(氣體體積均為已折合為標況下的體積)(氣體體積均為已折合為標況下的
8、體積)( ) 100(n-m)/11.2ag B.3100 (n-m)/agC.100 (n-m)/6ag D.100 (n-m)/(6a+n-m)g討論討論3 3:在標況下,將在標況下,將V L A氣體(摩爾質量為氣體(摩爾質量為M g/mol)溶于)溶于0.1 L水中,所得溶液密度為水中,所得溶液密度為d g/mL,則此溶液的物質的量為(,則此溶液的物質的量為( )2240MVVd1000.B2240MVVd.Ad) 1 . 0V(4 .22MV.D2240MVVdM1000.C練習:練習:在標準狀況下,把在標準狀況下,把1體積體積Cl2、5體積體積O2跟跟11體積體積H2混合,混合,這三
9、種氣體的物質的量之比是這三種氣體的物質的量之比是_,質量比是,質量比是_,混合氣體的平均相對分子質量是混合氣體的平均相對分子質量是_;如果在密閉容器中將混合;如果在密閉容器中將混合氣體用電火花引燃后,恰好完全反應,所得鹽酸(氣體用電火花引燃后,恰好完全反應,所得鹽酸(d=1.143g/cm3)的物質的量濃度是的物質的量濃度是_。15 1171 160 2214.99.04 mol /L(3)關于一定量溶液稀釋(或濃縮、混合)的計算)關于一定量溶液稀釋(或濃縮、混合)的計算 (稀溶液)(稀溶液)(濃溶液)(濃溶液)VcVc(稀溶液)(稀溶液)(濃溶液)濃溶液)mm(溶質的量不變(溶質的量不變(m
10、、n)注意體積:注意體積:近似處理近似處理 由由計算計算討論討論1 1:密度為密度為0.91g/cm3的氨水,質量分數為的氨水,質量分數為25 該氨水用等體該氨水用等體積的水稀釋后,所得溶液的質量分數為(積的水稀釋后,所得溶液的質量分數為( ) A 等于等于12.5 B 大于大于12.5 C 小于小于12.5 D 無法確定無法確定C結論:兩種同一溶質、不同質量分數的的溶液混合時結論:兩種同一溶質、不同質量分數的的溶液混合時等質量:等質量:( (混混)=)=(1 12 2)/2/2等體積:等體積:溶液密度大于溶液密度大于1:( (混混)(1 12 2)/2 /2 如如: :硫酸、氯化硫酸、氯化
11、鈉溶液鈉溶液溶液密度小于溶液密度小于1:( (混混)(1 12 2)/2/2 如:如:氨水、乙醇、甲酸溶液氨水、乙醇、甲酸溶液討論討論2 2:30%與與50 %的硫酸的硫酸混合混合 所得溶液的質量分數?所得溶液的質量分數?等質量混合等質量混合等體積混合等體積混合練習練習1:將質量分數為將質量分數為a%,物質的量濃度為,物質的量濃度為c1 mol/L稀硫酸蒸發掉稀硫酸蒸發掉一定量的水,使其質量分數為一定量的水,使其質量分數為2a%,此時若物質的量濃度為,此時若物質的量濃度為 c2 mol/L,則,則c1 與與c2的關系為(的關系為( ) A c2 =2c1 B c2 2c1 D c1 =2c2
12、C 練習練習2:將將100g 18 mol/L的硫酸加水稀釋為的硫酸加水稀釋為 9 mol/L,所加水的質,所加水的質量量_ 100g。(填大于、小于、等于)。(填大于、小于、等于)4、一定物質的量濃度溶液的配制、一定物質的量濃度溶液的配制討論討論1 1:怎樣配制怎樣配制 2mol/L 的的NaCl溶液溶液100mL?計算計算:n (NaCl)=2mol/L0.1L=0.2molm(NaCl)=0.2mol58.5g/mol=11.7g稱量:稱量:(天平的使用天平的使用?)溶解:溶解:在燒杯中用在燒杯中用20毫升蒸餾水使之完全溶解毫升蒸餾水使之完全溶解(注意:應冷卻,不可在容量瓶中溶解)(注意
13、:應冷卻,不可在容量瓶中溶解)轉移、洗滌:轉移、洗滌:移入移入100mL容量瓶,洗滌燒杯和玻璃棒兩容量瓶,洗滌燒杯和玻璃棒兩到三次(用玻璃棒引流)到三次(用玻璃棒引流)定容:定容:加水到接近刻度加水到接近刻度12厘米時,厘米時, 改用膠頭滴管加水到刻度,改用膠頭滴管加水到刻度,搖勻。裝入試劑瓶搖勻。裝入試劑瓶,貼標簽貼標簽. 注意事項:注意事項:(1 1)使用前要調零)使用前要調零(2 2)兩個托盤上各放一張大小相同的稱量紙)兩個托盤上各放一張大小相同的稱量紙(3 3)稱量時遵循左物右碼的原則)稱量時遵循左物右碼的原則(4 4)用鑷子夾取砝碼應按照從大到小的順序)用鑷子夾取砝碼應按照從大到小的
14、順序(5 5)稱量完畢應將砝碼放回盒中,游碼歸零)稱量完畢應將砝碼放回盒中,游碼歸零注意注意事項:事項:應在燒杯中溶解,不能在容量瓶中溶解。因為在應在燒杯中溶解,不能在容量瓶中溶解。因為在容量瓶上標有溫度和體積,這說明容量瓶的體積容量瓶上標有溫度和體積,這說明容量瓶的體積受溫度影響。而物質的溶解往往伴隨著一定的熱受溫度影響。而物質的溶解往往伴隨著一定的熱效應,如果用容量瓶進行此項操作,會因熱脹冷效應,如果用容量瓶進行此項操作,會因熱脹冷縮使它的體積不準確,嚴重時還可能導致容量瓶縮使它的體積不準確,嚴重時還可能導致容量瓶炸裂。炸裂。注意事項:注意事項: 由于容量瓶瓶頸較細,為避免液體由于容量瓶瓶
15、頸較細,為避免液體灑在外面,應用玻璃棒引流。灑在外面,應用玻璃棒引流。 用少量蒸餾水洗滌用少量蒸餾水洗滌2 23 3次,洗滌液要全次,洗滌液要全部轉移到容量瓶中。部轉移到容量瓶中。 用量筒量取液體藥品,量筒不必洗滌。用量筒量取液體藥品,量筒不必洗滌。步步高步步高P19討論討論2 2:怎樣用怎樣用98%的硫酸(密度的硫酸(密度1.84)配制)配制0.5mol/L的硫酸的硫酸500mL計算計算98%的濃硫酸的物質的量濃度為:的濃硫酸的物質的量濃度為:18.4mol/L由由C1V1= C2V218.4 V濃濃=0.5 500V濃濃=13.6 mL量取:量取:用量筒量取用量筒量取13.6mL98%的濃
16、硫酸,的濃硫酸,用燒杯裝適量蒸餾水,將量取的濃硫酸緩緩用燒杯裝適量蒸餾水,將量取的濃硫酸緩緩注入燒杯中,邊加邊攪拌注入燒杯中,邊加邊攪拌溶解:溶解:轉移、洗滌、定容轉移、洗滌、定容.同前同前濃濃 稀稀固配液固配液濃液配稀液濃液配稀液計算計算取量取量溶解溶解轉移、洗滌轉移、洗滌定容定容物質的量物質的量濃度溶液濃度溶液的配制的配制(稱取或量取)(稱取或量取)固體算質量固體算質量液體算體積液體算體積在燒杯中溶解在燒杯中溶解冷卻后冷卻后容量瓶容量瓶1、基本步驟、基本步驟 托盤天平、藥匙(固體溶質使用)、量筒、托盤天平、藥匙(固體溶質使用)、量筒、燒杯、玻璃棒、容量瓶、膠頭滴管燒杯、玻璃棒、容量瓶、膠頭滴管、2、實驗所需儀器、實驗所需儀器 3、實驗誤差分析、實驗誤差分析VMmVncBB稱量誤差稱量誤差mVCB砝碼銹蝕增重砝碼銹蝕增重砝碼、藥品放反砝碼、藥品放反在敞口容器中稱量易揮發在敞口容器中稱量易揮發性物質性物質量筒量取液體時俯視讀數量筒量取液體時俯視讀數量筒量取液體時仰視讀數量筒量取液體時仰視讀數增大增大減小減小/不變不變減小減小
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 與秋天有關的成語課件
- 不等式課件教學課件
- 云南師范大學《環境導視系統設計》2023-2024學年第二學期期末試卷
- 上海工商外國語職業學院《聲學基礎》2023-2024學年第一學期期末試卷
- 邵陽職業技術學院《向量微積分》2023-2024學年第一學期期末試卷
- 內蒙古包頭市青山區2025年初三年級校內模擬物理試題試卷(最后一卷)含解析
- 下載馬工程配套課件
- 江南影視藝術職業學院《從分子觀點了解生物學:結構生物學簡介》2023-2024學年第二學期期末試卷
- 遼源職業技術學院《藥物分析化學實驗》2023-2024學年第二學期期末試卷
- 江西省撫州市南城縣第一中學2025年高三下學期期中聯考物理試題理試題含解析
- 媒體宣發合同協議
- 變電站交、直流系統培訓課件
- 2025-2030中國消毒器械行業發展分析及發展趨勢預測與投資價值研究報告
- 2025年環保知識競賽賽題及答案(共70題)
- 2025屆青海省西寧市高三一模語文試題(原卷版+解析版)
- 2025年杭州市高三歷史4月二模質檢考試卷附答案解析
- 2025年中小學教師資格考試內容分析試題及答案
- 職場溝通職場溝通與人際關系處理知到課后答案智慧樹章節測試答案2025年春山東管理學院
- 2025屆云南省昆明市高三下學期“三診一模”教學質量檢測歷史試題(含答案)
- 專題03 文言文閱讀【知識精講精研】高二語文下學期期中考點大串講(統編版選擇性必修下冊)
- 安全隱患報告獎勵制度

評論
0/150
提交評論