



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
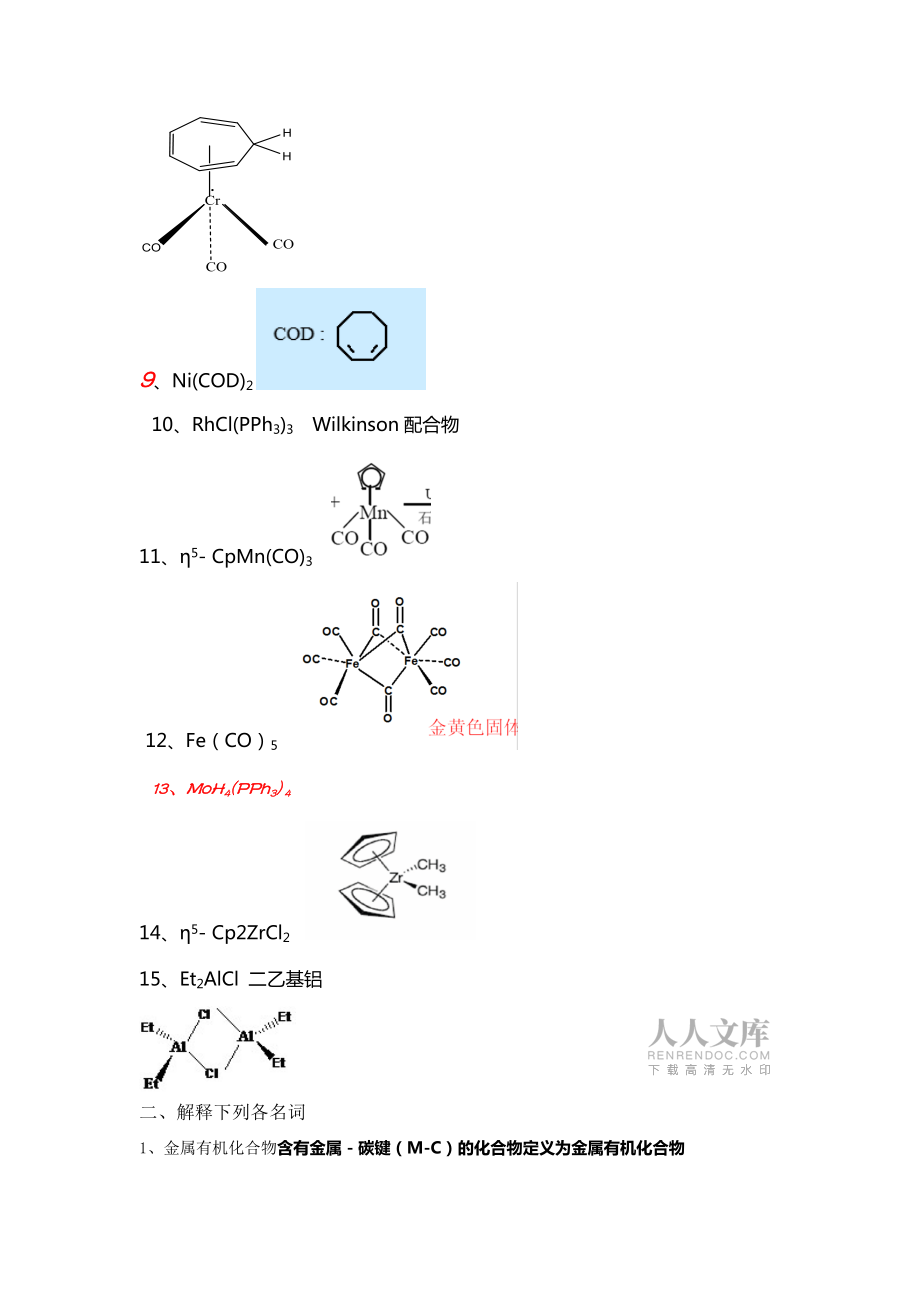
1、2011-2012學年第一學期金屬有機化學期末考試(本 )2011年12月一、寫出下列有機配體、金屬配合物、有機金屬化合物的結構或名稱1、Zeise鹽 2、Vaska配合物 3、Wilkinson配合物ClRh (Ph3P)3 4、BINAP 5、9-BBN 6、二環辛二烯合鎳 7、雙(5-環戊二烯基)合鐵 8、三(羰基)(1-6-6-環庚三烯)合鉻 9、Ni(COD)2 10、RhCl(PPh3)3 Wilkinson配合物 11、5- CpMn(CO)3 12、Fe(CO)5 13、MoH4(PPh3) 4 14、5- Cp2ZrCl2 15、Et2AlCl 二乙基鋁二、解釋下列各名詞1、
2、金屬有機化合物含有金屬碳鍵(M-C)的化合物定義為金屬有機化合物2、過渡金屬有機化合物含有過渡金屬碳鍵(M-C)的化合物, 過渡金屬含有d電子,在(n-1)d, ns, np原子構型中,(n-1)d軌道能級與ns接近,它們皆可參與成鍵。符合18電子規則。3、18電子規則對于穩定的單核反磁過渡金屬絡合物,其金屬外層的電子數與配體配鍵的電子數的總和等于18。只有當金屬具有穩定的惰性氣體結構時才能形成熱力學穩定的過渡金屬有機化合物。4、EAN電子規則過渡金屬配合物的中心(形成體)傾向于與一定數目的配體結合,以使自身周圍的電子數等于同周期稀有氣體元素的電子數 5、環狀多烯-金屬配合物 6、高自旋配合物
3、成對能(P)大于分裂能()的配合物, 當P時, 因電子成對需要的能量高, 電子將盡量以單電子排布分占不同的軌道, 取高自旋狀態。7、低自旋配合物成對能(P)小于分裂能()的配合物, 當P時, 電子成對耗能較少, 此時將取低自旋狀態。 8、反饋-鍵烯烴的電子配位到金屬的空軌道,形成授予鍵,同時充滿電子的金屬d 軌道與烯的反鍵空軌道*相重疊,形成反饋鍵。9、晶體場分裂能中心離子的d軌道的簡并能級因配位場的影響而分裂成不同 組能級之間的能量差, 以表示10、電子成對能所謂成對能是電子在配對時為了克服靜電場的排斥作用所需的能量, 通俗地講就是使自旋成對的兩個電子占據同一軌道所必須付出的能量, 以P表示
4、。 11、光譜化學序列將一些常見配體按光譜實驗測得的分裂能從小到大次序排列起來,便得光譜化學序列 12、配位飽和及配位不飽和滿足18電子規則的化合物稱為配位飽和的絡合物,否則為配位不飽和絡合物13、插入反應不飽和烴或含有孤對電子的化合物插入過渡金屬有機物的M-C, M-X或M-H鍵的反應稱為插入反應,其逆反應稱為反插入(脫出)反應 14、還原消除反應還原消除(reductive elimination)是氧化加成反應的逆反應,其氧化態及配位數均降低2。還原消除反應是一個協同過程,伴隨著氧化數降低和配位數減少,其實質是過渡金屬有機物的一種分解反應。還原消除反應是催化反應中給出有機產物的一步。 1
5、5、氧化加成反應中性分子加到配位不飽和的低價過渡金屬有機配合物上,使配合物中心金屬的配位數和氧化態都同時上升的反應 16、Heck反應在三乙胺存在下,醋酸鈀催化鹵代芳烴與烯烴反應生成苯乙烯型化合物 17、Suzuki偶聯反應 在Pd(PPh3)4催化下,芳基硼酸與溴或碘代芳烴的交叉偶聯反應. 該反應因具有反應條件溫和、可容忍多種活性官能團、受空間位阻影響不大、產率高以及芳基硼酸經濟易得且對潮氣不敏感等優越性而成為普遍適用的C一 C鍵 偶聯方法。 三、完成下列合成反應 , RhCl(PPh3)3 , C6H5Li, (C6H5)2CuLiFe(CO)5, Co2(CO)8, Co4(CO)12
6、Ni(COD)2, n-C4H9Li, ,(Bu)2CuLi, PhCH=CHCH2Bu, Grignard試劑合成方程式為: 硼氫化反應方程式為: 硼氫化反應是反馬氏規則的順式加成四、1970年Monsanto公司最先在工業上實現了手性銠配合物催化C=C不對稱加氫,合成治療帕金森綜合癥的特效藥L-Dopa。催化劑就是含手性雙膦配體(R, R)-Dipamp的Wilkinson型配合物,得到94%ee的L-Dopa。直到20世紀90年代Burk (杜邦公司)發現更好(99%ee)的配體DuPhos。后來,Noyori發現新類型的手性配體(R) or (S)-BINAP,其Rh絡合物催化不對稱氨
7、基酸合成的ee%最高達100%;后來用其Ru絡合物催化各種官能化烯烴的氫化,如用來合成非麻醉性消炎止痛藥Naproxen(萘普生) 和i-Buprofen(S-異丁基布洛芬)。試寫出這三種手性配體的結構式。五、完成下列敘述題1、 舉例說明何謂有機金屬化合物,何謂金屬配合物,它們在結構和性能上有何異同。金屬有機化合物含有金屬碳鍵(M-C)的化合物金屬與有機配體鍵合,但不存在直接的金屬碳鍵,也不是金屬有機化合物,而是配位化合物。2、簡述有機金屬化合物的特性。3、簡述配合物的18電子規則,并應用18電子規則說明下列化合物的穩定性差異。(1)Fe(5-C5H5)2 (2) Ti(5-C5H5)2 (3
8、) Co(5-C5H5)2Fe(5-C5H5)2 Fe2+ 6電子 C5H5- 6電子 6+2*6=18Ti(5-C5H5)2 Ti2+2電子 C5H5- 6電子 2+2*6=14 不穩定Co(5-C5H5)2 Co 2+ 6電子 C5H5- 6電子 6+2*6=18 不穩定,但可以再失1個電子來穩定4、簡述配合物的EAN規則和18電子規則,并應用18電子規則說明二茂鐵與二茂鎳的穩定性差異。(1)Fe(5-C5H5)2 (2) Ni(5-C5H5)2Fe(5-C5H5)2 Fe2+ 6電子 C5H5- 6電子 6+2*6=18Ni(5-C5H5)2 Ni 2+ 6電子 C5H5- 6電子 6+
9、2*6=18 不穩定,但可以再失1個電子來穩定5、根據晶體場理論說明二價鋅的配合物通常為無色配合物,而三價鈦分別與不同配體結合后產生不同顏色,如:Ti(OH2)63+帶有紫色這是因為在晶體場的影響下,過渡金屬離子的d軌道發生分裂,由于這些金屬離子的d軌道沒有充滿,在吸收了一部分光能后,就可產生從低能量的d軌道向高能量d軌道的電子躍遷,這種躍遷稱d-d躍遷。 配離子的顏色是從人射光中去掉被吸收的光,剩下來的那一部分可見光所呈現的顏色。吸收光的波長越短,表示電子躍遷(被激發)所需要的能量越大,亦即大,反之亦然。而Zn2+d-d分裂能值在可見光范圍外無色在配位場的作用下,裂分的這些d能級對理解經典的
10、配位化合物的吸收光譜、磁性和esr譜十分重要。但在金屬有機化學中,因為過渡金屬有機物中由d-d躍遷引起的光譜帶常被強的“電荷轉移”吸收所掩蓋。事實上,隨著10DQ變大,d-d躍遷光譜移至紫外區域。所以三價鈦分別與不同配體結合后產生不同顏色, Ti(OH2)63+帶有紫色6、簡述在八面體配合物中,d軌道裂分形成t2g軌道和eg軌道的原理并畫出能級裂分圖。7、簡述在四配位的正四面體過渡金屬配合物中,d軌道裂分形成t2軌道和e軌道的原理并畫出能級裂分圖,標出相應能級的軌道符號,計算出t值。 六、寫出下列過渡金屬催化反應的反應1、寫出乙烯通過催化水合反應合成乙醛的反應機理(畫出催化循環過程圖),并說明
11、每一步反應屬于何種基元反應。瓦克(Wacker)烯烴氧化反應 以順時針方向分別是配體解離,烯烴配位,烯烴插入和氧化加成,還原消除。 2、由丁烯在Wilkinson催化劑作用下合成戊醛的反應機理(畫出催化循環過程圖),并寫出每步基元反應的名稱。順時針分別是烯烴配位,配體解離,氧化加成,烯烴插入,配體配位,還原消除,氧化加成,配體解離,烯烴配位。 3、由Ni(CO)4催化下,由乙炔、乙醇合成丙烯酸乙酯的反應機畫出催化循環過程圖,并寫出每步基元反應的名稱。4、寫出在Wilkinson配合物RhCl(PPh3)3催化下,均相氫化合成4-(2-硝基乙基)亞甲二氧基苯的反應機理(畫出催化循環過程圖),并說
12、明每一步反應屬于何種基元反應。5給出金屬有機化學基元反應的各個名稱,并分別舉例說明。 配體的配位和解離; 氧化加成和還原消除;(3) 插入和脫出(反插入)反應;(4) 配體與外來試劑的反應6簡述18電子規則的原理及應用,并舉5個以上的典型例子加以說明。 18電子規則:對于穩定的單核反磁過渡金屬絡合物,其金屬外層的電子數與配體配鍵的電子數的總和等于18。只有當金屬具有穩定的惰性氣體結構時才能形成熱力學穩定的過渡金屬有機化合物。它是一個經驗規則,滿足18電子規則的化合物稱為配位飽和的絡合物,否則為配位不飽和絡合物。18電子規則的重要性:根據n+2x(CN)=18, 當電子數n固定時, 配合物的最高
13、配位數可推知, 同時也可以推測配合物的幾何構型。 d6電子構型,為六配位的八面體;d10電子構型,為四配位四面體。具有同種d電子構型的絡合物,配位數和配合物的構型相同。絡合物金屬(0) dn配體電子數總電子數Ni(CO)4Ni = 104(CO) = 4 × 218-C5H5V(CO)4V = 54(CO) = 4 × 2; -C5H5 = 518Mn2(CO)102Mn = 2 × 710(CO) = 10 × 2; Mn-Mn = 218-C3H5Fe(CO)2NOFe = 82(CO) = 2 × 2; NO = 3-C3H5 = 3187Fischer型卡賓和Schrock型卡賓在結構特點和反應性能上的不同之處在于:Fischer型卡賓特點:含有一個或兩個與卡賓C相連的雜原子(O, N )。 卡賓C具有親電性,易受親核試劑進攻。 親電試劑可以進攻帶孤對電子的卡賓雜原子。 卡賓配體的-H酸性較強,可被堿除去,生成金屬卡賓陰離子,它可進一步與各種親電試劑反應。 金屬卡賓中的羰基可被其它配體取代。Schrock型卡賓特點:與卡賓C相連的只有碳或氫原子。又稱烴叉絡合物e. 卡賓碳可被親電試劑進攻f. 強
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 定制旅行路線協議
- 植物油脂化學成分分析考核試卷
- 涂料店鋪顧客引流策略考核試卷
- 筆的書寫力道調節考核試卷
- 石油開采安全生產考核試卷
- 電子出版物線上線下融合發展趨勢考核試卷
- 經濟型連鎖酒店品牌競爭力分析考核試卷
- 聚氧化乙烯纖維單體制備考核試卷
- 紡織原料預處理設備考核試卷
- 租賃合同模板設計與條款完善考核試卷
- 解讀功能性食品研發
- 京東自營購買合同范例
- 急性胰腺炎護理查房-5
- 公務用車分時租賃實施方案
- DB3301∕T 0451-2024 醫學美容機構電子病歷系統技術規范
- 《大國浮沉500年:經濟和地理背后的世界史》記錄
- 水工維護初級工技能鑒定理論考試題庫(含答案)
- 運維項目進度計劃
- 商場中央空調租賃協議模板
- 十八項核心制度
- 浙江省杭州市2023-2024學年六年級下學期期中模擬測試數學試卷(人教版)

評論
0/150
提交評論