



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
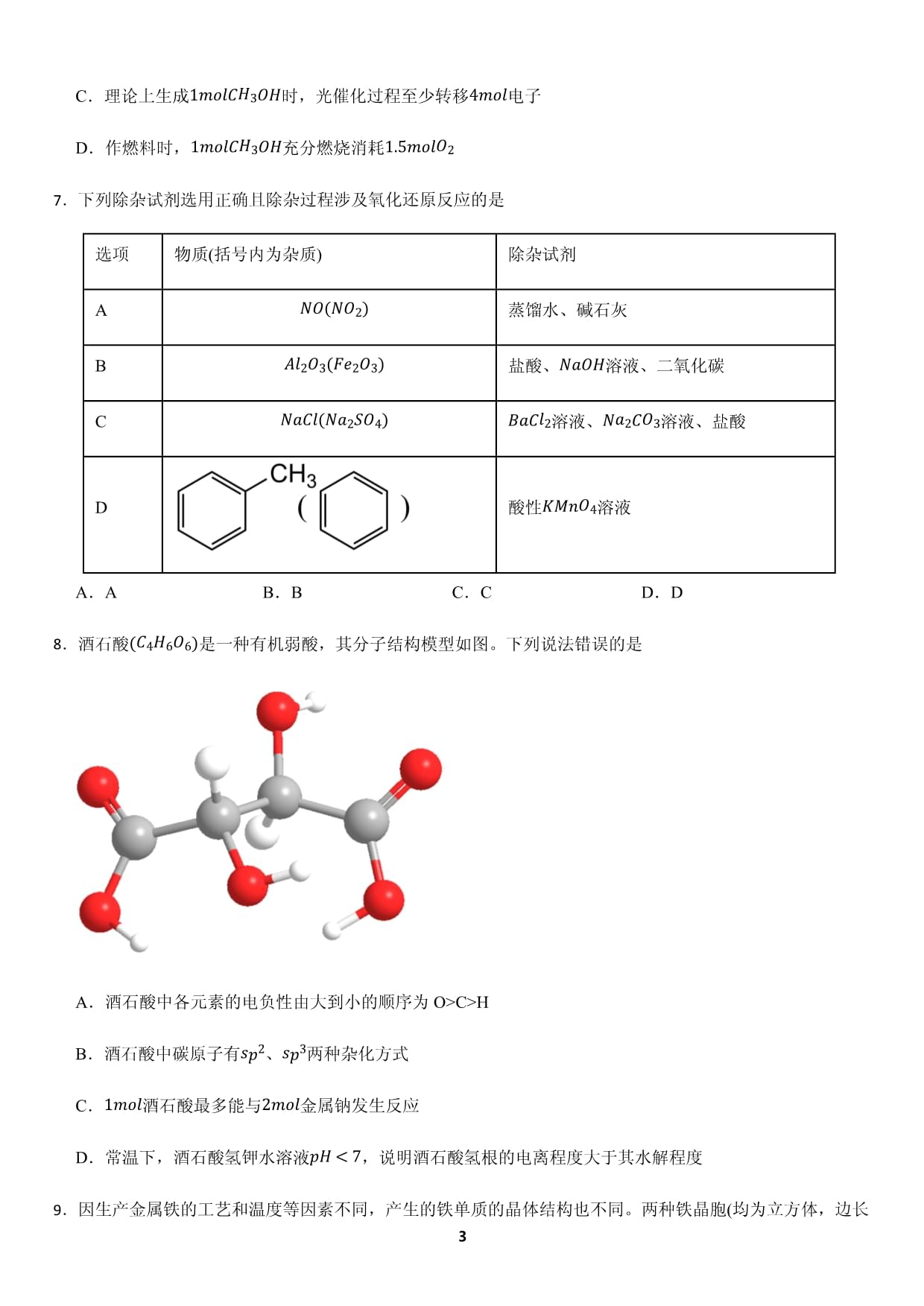
北京市東城區2022-2023學年高三上學期1月期末統一檢測化學試卷姓名:__________班級:__________考號:__________題號一二總分評分一、單選題1.文物是人類寶貴的歷史文化遺產。按制作文物的主要材料分類,下列文物屬于金屬文物的是文物選項A.青銅亞長牛尊B.虎形玉佩C.甲骨片D.豎線劃紋黑陶尊A.A B.B C.C D.D2.下列化學用語或圖示表達錯誤的是A.Br的原子結構示意圖:B.乙炔的分子結構模型:C.氮分子的電子式:D.基態24Cr的簡化電子排布式:3.表示下列反應的方程式正確的是A.鐵粉與水蒸氣共熱,生成可燃性氣體:2Fe+3B.向FeCl3C.向Mg(OH)2濁液中加入FeCD.向FeSO4溶液中滴加H4.用NAA.4g12B.1L0.1mol?L?1C.標準狀況下,11.2LO2D.0.1molNa與10mL05.用如圖裝置進行實驗,電流計指針偏轉。下列說法錯誤的是A.該裝置將化學能轉化為電能B.K+C.工作一段時間,a極附近溶液pH會減小D.該裝置的總反應為H6.我國科學家分別攻克了兩大催化技術,使合成“液態陽光”的兩個生產環節效率大幅提高。“液態陽光”的合成示意圖如下。下列說法錯誤的是A.甲醇的沸點遠遠高于乙烷,是由于甲醇分子之間存在氫鍵B.催化劑通過降低相應反應的活化能使化學反應速率增大C.理論上生成1molCH3OHD.作燃料時,1molCH37.下列除雜試劑選用正確且除雜過程涉及氧化還原反應的是選項物質(括號內為雜質)除雜試劑ANO(N蒸餾水、堿石灰BA鹽酸、NaOH溶液、二氧化碳CNaCl(NBaCl2溶液、D酸性KMnOA.A B.B C.C D.D8.酒石酸(C4HA.酒石酸中各元素的電負性由大到小的順序為O>C>HB.酒石酸中碳原子有sp2、C.1mol酒石酸最多能與2mol金屬鈉發生反應D.常溫下,酒石酸氫鉀水溶液pH<7,說明酒石酸氫根的電離程度大于其水解程度9.因生產金屬鐵的工藝和溫度等因素不同,產生的鐵單質的晶體結構也不同。兩種鐵晶胞(均為立方體,邊長分別為以anm和1.22anm)的結構示意圖如下。下列說法錯誤的是A.用X射線衍射可測定鐵晶體的結構B.圖2代表的鐵單質中,一個鐵原子周圍最多有4個緊鄰的鐵原子C.圖1與圖2代表的鐵單質中,原子之間以金屬鍵相互結合D.圖1與圖2代表的鐵單質的密度不同10.向NaOH溶液中持續滴加稀鹽酸,記錄溶液pH及溫度隨時間的變化如圖所示。下列說法正確的是A.NaOH溶液的起始濃度為1B.在滴定至終點的過程中,水的電離程度不斷減小C.t1sD.由t2s后溶液的溫度變化可推知,NaOH與11.交聯聚合物P的結構片段如圖所示。[圖中表示鏈延長,R為-(CH下列說法錯誤的是A.聚合物P難溶于水,但有高吸水性B.合成聚合物P的反應為加聚反應C.聚合物P的單體之一存在順反異構現象D.1,4-戊二烯與丙烯共聚也可形成類似聚合物P骨架的交聯結構12.侯氏制堿法工藝流程如圖所示。下列說法錯誤的是A.飽和食鹽水“吸氨”的目的是使“碳酸化”時產生更多的B.煅燒時發生反應2NaHCC.“鹽析”后溶液pH比“鹽析”前溶液pH大D.母液Ⅱ與母液Ⅰ所含粒子種類相同,但前者Na+、、13.環己烯是有機合成的重要中間體,可由環己烷氧化脫氫制備。已知幾種物質的燃燒熱(25℃,101kPa):名稱氫氣環己烯環己烷化學式(狀態)HCCΔH?285?3786?3953下列說法正確的是A.氫氣燃燒的熱化學方程式為2H2B.由燃燒熱可知,環己烯的能量小于環己烷的能量C.(l)=(l)+H2(g)ΔH=+119.4kJ?moD.環己烷氧化脫氫制備環己烯時,氧氣和高錳酸鉀均可作氧化劑14.研究碘在不同溶劑中的溶解性。進行實驗:①向試管中放入一小粒碘晶體,再加入蒸餾水,充分溶解后,得到黃色溶液a和少量不溶的碘;②取5mL溶液a,加入1mL四氯化碳,振蕩,靜置,液體分層,下層呈紫色,上層無色;③將②所得下層溶液全部取出,加入1mLKI溶液,振蕩,靜置,下層溶液紫色變淺,上層溶液b呈黃色(顏色比溶液a深)。已知:ⅰ.3Iⅱ.I2下列說法錯誤的是A.H2O是極性溶劑,CCl4B.②中的下層溶液為碘的四氯化碳溶液C.溶液b中c(I2D.向①所得濁液中加入KI,使c(I-二、綜合題15.硅烷廣泛應用在現代高科技領域。制備硅烷的反應為SiF(1)①基態硅原子的價層電子軌道表示式為。②SiF4中,硅的化合價為+4價。硅顯正化合價的原因是③下列說法正確的是(填序號)。a.SiF4的熱穩定性比b.SiH4中4個Si?H的鍵長相同,H?Si?Hc.SiH4中硅原子以4個sp3雜化軌道分別與4個氫原子的④SiF4的沸點(?86℃)高于SiH4的沸點((2)NaAlH4的晶胞結構如圖所示,晶胞的體積為①AlH4?②用NA表示阿伏加德羅常數的值。NaAlH4晶體密度為g?c③NaAlH4是一種具有應用潛能的儲氫材料,其釋氫過程可用化學方程式表示為:3NaAlH4=Na3AlH16.乙二醛是一種重要的精細化工產品,可由乙醛硝酸氧化法制備。(1)Ⅰ.研究其他條件相同時,僅改變一個條件對乙二醛制備的影響,獲得如下數據。乙二醛的結構簡式是。(2)圖1中,曲線a對應的溫度是,判斷的依據是。(3)圖2中,c→d乙二醛的產率降低,并檢測出較多的副產物,如乙二酸。產生較多乙二酸的原因是。(4)Ⅱ.運用電化學原理設計分離純化乙二醛并回收硝酸的裝置示意圖如下(電極均為惰性電極)。與電源負極相連的是(填“X”或“Y”)。(5)結合電極反應分析硝酸回收原理:。(6)測定純化后溶液中乙二醛的含量。ⅰ.移取VmL純化后的溶液于錐形瓶中,加入2滴酚酞溶液,用濃度為0.ⅱ.向ⅰ所得溶液加入過量0.50mol?Lⅲ.試用0.50mol?L已知:乙二醛在強堿性溶液中發生反應生成CH該純化后的溶液中乙二醛的含量為g?L?1(乙二醛摩爾質量:17.鹽酸阿扎司瓊(S)是一種高效5?HT3受體拮抗劑,其合成路線如下。已知:(1)A中官能團的名稱是。(2)A→B的反應類型是。(3)B→C的化學方程式是。(4)E的結構簡式是。(5)K的合成路線如下。已知:①K分子中有個手性碳原子,在結構簡式上用“*”標記出來(如沒有,填“0”,不用標記)。②H的結構簡式為或。③參考上述流程中的信息,以乙醇、乙酸為起始原料,兩步合成乙酰乙酸乙酯(),寫出相應的化學方程式:、。18.碳酸鋰是制備其他鋰化合物的關鍵原料。一種以磷酸鋰渣(主要成分Li已知:部分物質的溶解性表(20℃)陽離子陰離子PHPHL難溶可溶易溶C難溶難溶可溶(1)寫出浸取時Li3P(2)加入鹽酸的量不宜過多的原因是。(3)鈣渣的主要成分是。(4)磷鋰分離時,需要不斷加入適量NaOH溶液以維持溶液的pH基本不變。結合離子方程式解釋其原因是。(5)沉鋰時,反應的離子方程式是。(6)若粗制LiCl溶液中c(Li+)=4mol?L?1,c(Ca2+)=2×10?4mol?L?1。則沉鋰前溶液中能達到的19.某小組根據SO2既有還原性又有氧化性,探究其能否實現Cu已知:ⅰ.水合Cu+既易被氧化也易被還原,因此水溶液中無法生成水合ⅱ.CuCl為白色固體,難溶于水,可溶于c(Cl?)較大的溶液生成[CuC(1)Ⅰ.SO2與向試管中通入足量SO裝置編號試劑實驗現象a1mol?L始終無明顯變化b1mol?L溶液變綠,進而變棕黃色,一段時間后出現白色沉淀基態29Cu+(2)將b所得沉淀過濾,充分洗滌,進行下列實驗,證實該沉淀為CuCl。①證明白色沉淀中有Cu+,推理過程是②ⅲ排除了干擾Cl?檢驗的因素。寫出ⅲ中反應的離子方程式:(3)進一步證實b中SO2作還原劑,補全實驗方案和預期現象:取b中反應后的上層清液于試管中,(4)由實驗Ⅰ可推知,該條件下:①a中SO2不能將Cu2+還原為②SO2、CuCl、Cu的還原性由強到弱的順序為綜上所述,改變還原產物的價態或形態可以影響氧化還原反應能否發生。(5)Ⅱ.SO2與向試管中通入足量SO裝置編號試劑實驗現象c3mol?L始終無明顯變化d3mol?L銅片表面變黑,溶液變為棕色證明d所得棕色溶液含有[CuCl3](6)經進一步檢驗,銅表面黑色物質為Cu2Cu+SO2+Cl?+_=Cu(7)與c對比,d能發生反應的原因是。
答案解析部分1.【答案】A【解析】【解答】A.青銅主要由銅、錫含有少量鉛的合金,屬于金屬文物,故A選;B.玉佩主要成分為玉石,屬于礦物質,為含硅化合物,不屬于金屬文物,故B不選;C.胛骨片主要成分為動物骨骼,屬于無機非金屬文物,故C不選;D.豎線劃紋黑陶尊主要成分為硅酸鹽等含硅化合物,不屬于金屬制品,故D不選;故答案為:A。
【分析】A.青銅為合金;
B.玉的主要成分為硅酸鹽材料;
C.甲骨片的主要成分為碳酸鈣等;
D.豎線劃紋黑陶尊主要成分為二氧化硅和硅酸鹽。2.【答案】D【解析】【解答】A.Br元素原子序數35,根據核外電子排布規律,Br原子結構示意圖為,故A不符合題意;B.乙炔的結構簡式為CH≡CH,C原子采用SP雜化,為直線形分子,其分子結構模型為,故B不符合題意;C.氮氣分子屬于共價型分子,最外層滿足8電子穩定結構,電子式為,故C不符合題意;D.Cr元素原子序數24,原子核外24個電子,基態24Cr的簡化電子排布式:[Ar]3故答案為:D。
【分析】A.Br原子的質子數和電子數都是35,核外各層上電子數分別為2、8、18、7;
B.乙炔是直線形分子,含有C≡C鍵和C-H鍵,并且C原子半徑大于H;
C.氮氣分子中N原子間共用3對電子,N原子最外層達到8電子穩定結構。3.【答案】B【解析】【解答】A.鐵粉與水蒸氣共熱生成Fe3O4和H2,A不符合題意;B.向FeCl3溶液中加入銅片,Fe3+與Cu反應生成Fe2+和Cu2+,溶液由黃色變成藍色,離子方程式為C.Mg(OH)D.向FeSO4溶液中滴加H2O2溶液的離子方程式為2Fe2++H2O2+2H+故答案為:B。
【分析】A.鐵與水蒸氣共熱反應生成四氧化三鐵和氫氣;
C.氫氧化鎂為固體,應保留化學式;
D.向FeSO4溶液中滴加H2O2溶液,發生反應2Fe2++H2O2+2H+4.【答案】D【解析】【解答】A.4g12H2的物質的量為B.由于Al3+的水解,溶液含有的Al3+個數小于C.標準狀況下,11.2LO2和N2D.Na在反應過程中轉移1個電子,因此0.1molNa與10mL0.故答案為:D。
【分析】A.根據n=mM計算;
B.鋁離子在溶液中發生水解;
C.根據5.【答案】D【解析】【解答】A.該裝置為原電池,可將化學能轉化為電能,A項不符合題意;B.原電池中陽離子從負極移向正極,因此K+C.a極電極反應為:H2?2e?+2OD.因為H2在a極放電后消耗了OH-,K+從a極經陽離子交換膜移向b極,與生成的Cl-形成KCl,因此總反應不是H故答案為:D。
【分析】該裝置為原電池,通入氫氣的a極為負極,電極反應式為H2?2e6.【答案】C【解析】【解答】A.甲醇中存在醇羥基,能夠形成氫鍵,所以甲醇的沸點遠遠高于乙烷,是由于甲醇分子之間存在氫鍵,A不符合題意;B.催化劑可以降低相應反應的活化能,使化學反應速率加快,B不符合題意;C.由示意圖可知H2和CO2在催化劑②催化下生成甲醇,CO2的化合價由+4價降低到甲醇的-2價,理論上生成1molCH3OHD.根據CH3OH燃燒方程式2CH3OH+3O2點燃__2CO2+4H2O,1molCH3OH故答案為:C。
【分析】A.甲醇分子間形成氫鍵;
B.催化劑可降低反應的活化能,加快反應速率;
D.CH3OH燃燒的化學方程式為CH3OH+3O2點燃__2CO2+4H7.【答案】A【解析】【解答】A.除去NO中的NO2,先通入蒸餾水中,發生反應B.除去Al2O3中含有的Fe2O3,先加入鹽酸,涉及反應Al2O3+6H+C.除去NaCl中含有的Na2SO4,先加過量BaCl2溶液發生反應BD.除去甲苯的苯,加入酸性KMnO故答案為:A。
【分析】氧化還原反應中一定有元素的化合價發生變化。8.【答案】C【解析】【解答】A.同周期從左到右,金屬性減弱,非金屬性變強,元素的電負性變強;同主族由上而下,金屬性增強,非金屬性逐漸減弱,元素電負性減弱;酒石酸中各元素的電負性由大到小的順序為O>C>H,故A不符合題意;B.酒石酸中飽和碳原子為sp3雜化,羧基中碳原子為為C.羧基和羥基均可以和鈉單質反應,故1mol酒石酸最多能與4mol金屬鈉發生反應,故C符合題意;D.常溫下,酒石酸氫鉀水溶液pH<7,說明酒石酸氫根的電離程度大于其水解程度,導致氫離子濃度大于氫氧根離子濃度,故D不符合題意;故答案為:C。
【分析】A.元素的非金屬性越強,電負性越大;
B.酒石酸中,飽和碳原子采用sp3雜化,雙鍵碳原子采用sp2雜化;
D.酒石酸氫鉀水溶液pH<7,說明酒石酸氫根的電離程度大于其水解程度。9.【答案】B【解析】【解答】A.晶體與非晶體的最可靠的科學方法是X射線衍射法;X射線衍射可測定鐵晶體的結構,故A不符合題意;B.圖2代表的鐵單質中,以底面中心的原子為例,上層、同層、下層各有4個緊鄰的原子,故一個鐵原子周圍最多有12個緊鄰的鐵原子,故B符合題意;C.鐵為金屬晶體,鐵單質中,原子之間以金屬鍵相互結合,故C不符合題意;D.圖1中,據“均攤法”,晶胞中含8×18+1=2個Fe,則晶體密度為m故答案為:B。
【分析】A.X-射線衍射實驗是區分晶體和非晶體最科學的方法;
C.金屬晶體中,相鄰的金屬原子之間存在金屬鍵;
D.根據均攤法和ρ=m10.【答案】C【解析】【解答】A.如圖,未滴加鹽酸時,溶液pH最大,NaOH屬于強堿,起始時NaOH溶液pH=a,c(H+)=10?amol?LB.任何酸或堿均抑制水的電離,在滴定至終點的過程中,NaOH濃度減小,水的電離程度不斷增大。剛好反應時,達到最大,故B不符合題意;C.t1s時,NaOH過量,溶質為NaOH和NaCl;t3s時,鹽酸過量,溶質為HCl和NaCl,所以根據電荷守恒,D.如圖,曲線a到b為中和曲線,b點時剛好反應完全,此時反應溫度最高,由此可知,NaOH與HCl的反應是放熱反應,故D不符合題意;故答案為:C。
【分析】A.根據KW=c(OH11.【答案】C【解析】【解答】A.聚合物P中雖然含有-COONa結構,但由于碳原子數較多,所以難溶于水,但由于-COONa有強極性,所以聚合物P有高吸水性,故A不符合題意;B.聚合物P高分子鏈全部為碳原子,所以合成聚合物P的反應為加聚反應,故B不符合題意;C.根據聚合物P的結構可知,合成聚合物P的單體為CH2=CH-R-CH=CH2和CH2=CH-COONa,不存在順反異構,故C符合題意;D.1,4-戊二烯與丙烯與聚合物P的單體結構相似,能形成類似交聯結構,故D不符合題意;故答案為:C。
【分析】A.-COONa具有較強的極性,聚合物P有高吸水性;
B.聚合物P高分子鏈全部為碳原子;
C.碳碳雙鍵兩端的碳原子連接2個不同的原子或原子團時存在順反異構;
D.1,4﹣戊二烯與丙烯共聚只能形成鏈狀結構。12.【答案】D【解析】【解答】A.氨氣極易溶于水使溶液顯堿性,飽和食鹽水“吸氨”的目的是可以吸收更多二氧化碳,使“碳酸化”時產生更多的,故A不符合題意;B.碳酸氫鈉受熱分解為碳酸鈉、水、二氧化碳,故B不符合題意;C.銨根離子水解生成氫離子,溶液顯酸性;加入氯化鈉“鹽析”后溶液中銨根離子濃度減小,溶液酸性減弱,故pH比“鹽析”前溶液pH大,故C不符合題意;D.母液Ⅱ為加入氯化鈉晶體,析出氯化銨后得到的;與母液Ⅰ所含粒子種類相同,但母液Ⅱ中碳酸氫根離子的濃度沒有變的更大,故D符合題意;故答案為:D。
【分析】合成氨工業提供的氨氣通入飽和食鹽水中,再通入二氧化碳碳酸化,過濾得到母液Ⅰ,“吸氨”操作目的是將碳酸氫鈉轉化為碳酸鈉,同時增大銨根離子濃度,吸收氨氣后降溫冷析得到氯化銨晶體,濾液中加入氯化鈉鹽析得到母液Ⅱ主要是飽和食鹽水,再循環使用,過濾得到的碳酸氫鈉晶體煅燒得到碳酸鈉為純堿,生成的二氧化碳重新回到碳酸化步驟循環使用。13.【答案】C【解析】【解答】A.燃燒熱是在101kPa時,1mol物質完全燃燒生成穩定的氧化物時所放出的熱量;氫氣燃燒的熱化學方程式為H2(g)+1B.等量的環己烯、環己烷燃燒耗氧量、生成水的量不同,由燃燒熱不能判斷環己烯的能量小于環己烷的能量,B不符合題意;C.由燃燒熱可知,①H2(g)+②C6H③C6H由蓋斯定律可知,③-①-②得:(l)=(l)+H2(g)ΔH=+119.4kJ?molD.環己烯中含有碳碳雙鍵,會被高錳酸鉀氧化,D不符合題意;故答案為:C。
【分析】A.燃燒熱是1mol可燃物完全燃燒產生穩定的氧化物時放出的熱量;
B.等量的環己烯和環己烷燃燒耗氧量、生成水的量不同,由燃燒熱不能判斷環己烯和環己烷的能量大小;
D.環己烯中的碳碳雙鍵會被高錳酸鉀氧化。14.【答案】D【解析】【解答】A.根據相似相溶原理,H2O是極性溶劑,CCl4是非極性溶劑,非極性的B.四氯化碳密度大于水且與水互不相溶,②中的下層溶液為碘的四氯化碳溶液,B不符合題意;C.加入碘化鉀,I2+I??I3D.向①所得濁液中加入KI,使c(I-)增大,I2+故答案為:D。
【分析】A.根據相似相溶原理分析;
B.四氯化碳密度大于水;
C.加入碘單質,發生反應I215.【答案】(1);SiF4中Si原子和F原子之間共價鍵連接,其中F原子的吸電子能力強,共用電子對偏向F因此硅顯正化合價;;ac;;SiF4的相對分子質量大于SiH(2)正四面體;;216×1021a2b【解析】【解答】(1);SiF4a.熱穩定性決定于該分子中的化學鍵的強度,化學鍵越強,熱穩定性越強,SiF4的熱穩定性比b.SiH4中4個Si-H的鍵長相同,c.SiH4分子中的Si原子以4個故答案為:ac。組成和結構相似的分子,相對分子質量越大,范德華力越大,熔沸點越大,SiF4的相對分子質量大于SiH4,因此(2)AlH4-中有4個σ鍵,0個孤電子對,因此其VSEPR模型為正四面體構型;根據均攤法可知,晶胞中AlH4-的數目為1+8×18+4×12=4,Na+數目為6×12+4×14=4,則二者配位數為1:1,以體心的
【分析】(1)①硅原子最外層有4個價電子,價層電子排布式為3s23p2;
②SiF4分子中氟和硅以共價鍵相連,F原子吸電子能力比Si原子強,則共用電子對偏向F原子,因此F顯負價,Si顯正價;
③a.C的非金屬性比Si元素強,則SiF4的熱穩定性比CH4的差;
b.SiF4分子為正四面體結構;
c.SiH4分子中硅原子雜化方式為sp3雜化,Si原子以4個sp3雜化軌道分別與4個氫原子的1s軌道重疊,形成4個Si-Hσ鍵;
④SiF4和SiH4均為分子晶體,且結構相似,SiF4的相對分子質量大于SiH4,則SiF4分子間范德華力強;
(2)①AlH4-中中心原子價層電子對數為4,不含孤電子對;
②根據均攤法和ρ=mV計算;
③2216.【答案】(1)HCOCHO(2)137℃;起始階段相同時間內曲線a對應的乙二醛濃度變化更大(3)硝酸具有強氧化性,硝酸濃度增大,導致副反應速率增大使得乙二醛被氧化為乙二酸(4)X(5)Y極上水放電發生氧化反應生成氧氣和氫離子,2H(6)58(0【解析】【解答】(1)乙二醛的結構簡式是HCOCHO;(2)溫度越高,化學反應速率越快,根據先拐先平數值大,可知曲線a對應的溫度是137℃,原因是起始階段相同時間內曲線a對應的乙二醛濃度變化更大;(3)硝酸具有強氧化性,硝酸濃度增大,導致副反應速率增大使得乙二醛被氧化為乙二酸;(4)運用電化學原理設計分離純化乙二醛并回收硝酸,則B中硝酸根離子向C室移動,電解池中陰離子向陽極移動,則Y為陽極、X為陰極,X與電源負極相連;(5)Y極上水放電發生氧化反應生成氧氣和氫離子,2H(6)2NaOH+H2SO4=Na2S
【分析】(1)乙二醛的結構簡式為HCOCHO;
(2)溫度越高,化學反應速率越快;
(3)酸具有強氧化性,硝酸濃度增大,導致副反應速率增大使得乙二醛被氧化為乙二酸;
(4)B中硝酸根離子向C室移動,則Y為陽極、X為陰極;
(5)Y極上水放電發生氧化反應生成氧氣和氫離子,2H2O-4e-17.【答案】(1)酯基、酚羥基(2)取代反應(3)(4)(5)1;;;;CH3CH2OH+CH3COOH?Δ濃硫酸CH3COOCH2CH3+H2O;2CH3COOCH2CH3→(CH3)3COKCH3COCH2COOC2H5【解析】【解答】(1)A中官能團的名稱是酯基、酚羥基;(2)由分析可知,A→B的反應類型是取代反應;(3)B發生硝化反應在酚羥基鄰位引入-NO2得到C,反應為;(4)E的結構簡式是;(5)①手性碳原子是連有四個不同基團的碳原子;,如圖K分子中有1個手性碳原子;②G跟著存在2個酯基,根據已知反應原理,則H的結構簡式為或。③乙醇和乙酸反應發生酯化反應生成乙酸乙酯,CH3CH2OH+CH3COOH?Δ濃硫酸CH3COOCH2CH3+H乙酸乙酯反應已知反應原理生成CH3COCH2COOC2H5,反應為2CH3COOCH2CH3→(CH3)3COKCH3COCH2COOC2H
【分析】A發生取代反應生成B,結合B的分子式可知,B為,B中苯環上酚羥基的鄰位氫原子被硝基取代生成C為,C中硝基發生還原反應生成D中氨基,則D為,D發生取代反應生成E為,D中亞氨基上的氫原子被甲基取代然后堿性條件下水解、酸化得到F,F和K發生反應生成S。18.【答案】(1)Li3P(2)盡量減少后序磷鋰分離時NaOH的用量(3)CaHP(4)溶液中存在反應Ca2++H2PO4?=CaHP(5)2Li++CO32-=Li2(6)2【解析】【解答】(1)磷酸鋰渣加入鹽酸浸取時生成Li+、H2PO4?、Cl-,因此L(2)在磷鋰分離時還需要加入NaOH調節pH,因此浸取時加入鹽酸的量不宜過多,減少后序磷鋰分離時NaOH的用量;(3)根據溶解性表可知,磷鋰分離時加入CaCl2溶液和NaOH溶液,生成可溶性的LiCl和難溶性的CaHPO4,鈣渣的主要成分是(4)在溶液中存在反應Ca2++H2PO4?=CaHP(5)沉鋰時,Li+與CO32-結合生成Li2CO3沉淀,反應的離子方程式是2Li++CO3(6)要求Li+不能沉淀,Ca2+形成沉淀Ca
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 四川省瀘州市瀘縣重點名校2025屆初三下第六次周考生物試題含解析
- 寧夏長慶高級中學2025屆高三第一次高考模擬考試生物試題含解析
- 浙江省金華市聚仁教學集團2025年初三下學期第一次摸底考試英語試題試卷含答案
- 云南省大理白族自治州南澗彝族自治縣2024-2025學年五年級數學第二學期期末經典模擬試題含答案
- 遼寧省朝陽市凌源市凌源三中2024-2025學年高三第四次調研考試生物試題含解析
- 吉林省吉林市第五十五中學2025年高三4月模擬考試數學試題含解析
- 電子書銷售合同模板
- 個人家具買賣合同
- 二手住宅交易協議樣本
- 編劇委托創作合同范本
- 《尼爾斯騎鵝旅行記》讀書分享課件
- Unit 2 Morals and Virtues Listening and Speaking教學設計-2024-2025學年人教版高中英語必修第三冊
- (統編2024版)語文一年級下冊第七單元解析+任務目標+大單元教學設計
- 消毒供應中心外來醫療器械管理
- 第六章學習法治思想提升法治素養講解
- 醫務人員職業暴露的預防及處理課件
- 2025年內蒙古自治區包頭市中考試卷數學模擬卷(二)
- 2025年華潤燃氣招聘筆試參考題庫含答案解析
- 《產業經濟學》期末考試復習題及答案
- 法定傳染病診斷標準2023年
- 高校食堂飯菜價格管理制度

評論
0/150
提交評論