



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
1、第一章第一章 原子結構與性質原子結構與性質第二節 原子結構與元素的性質 (第2課時)上上 節節 知知 識識 掃掃 描描1 1、原子的電子排布與周期的劃分、原子的電子排布與周期的劃分2 2、原子的電子排布與族的劃分、原子的電子排布與族的劃分 主族元素:族序數主族元素:族序數= =原子的最外層電子數原子的最外層電子數 = =價電子數價電子數 副族元素:大多數族次副族元素:大多數族次= =(n-1)d+nsn-1)d+ns的的 電子數電子數= =價電子數價電子數3 3、原子的電子構型和元素的分區、原子的電子構型和元素的分區周期序數周期序數= =能層數能層數5 5個區:個區:s s區、區、d d區、區
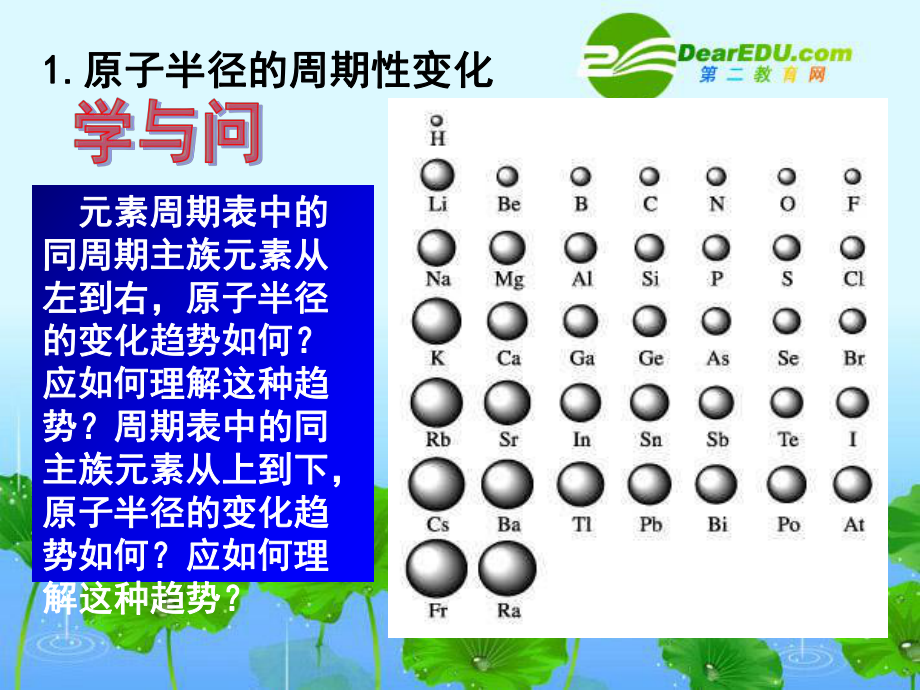
2、、dsds區、區、p p區、區、f f區。區。一、原子結構與元素周期表一、原子結構與元素周期表二、元素周期律二、元素周期律 元素的性質隨(元素的性質隨( )的遞增發生)的遞增發生周期性的遞變,稱為周期性的遞變,稱為元素的周期律元素的周期律。 核電荷數核電荷數包括:包括: 原子半徑原子半徑 、元素的金屬性和非、元素的金屬性和非金屬性、元素化合價、電離能和電金屬性、元素化合價、電離能和電負性等的周期性的變化。負性等的周期性的變化。1.1.原子半徑的周期性變化原子半徑的周期性變化 元素周期表中的元素周期表中的同周期主族元素從同周期主族元素從左到右,原子半徑左到右,原子半徑的變化趨勢如何?的變化趨勢如
3、何?應如何理解這種趨應如何理解這種趨勢?周期表中的同勢?周期表中的同主族元素從上到下,主族元素從上到下,原子半徑的變化趨原子半徑的變化趨勢如何?應如何理勢如何?應如何理解這種趨勢?解這種趨勢?(一)原子半徑(一)原子半徑1 1、影響因素、影響因素: :2 2、規律:、規律:(1 1)電子層數不同時)電子層數不同時, ,電子層數越多電子層數越多, ,原子半徑越大。原子半徑越大。二、元素周期律二、元素周期律原子半原子半徑大小徑大小取決于取決于(1)(1)電子的能層數電子的能層數(2)(2)核電荷數核電荷數(2 2)電子層相同時)電子層相同時, ,核電荷數越大,原子半徑越小。核電荷數越大,原子半徑越
4、小。(3 3)電子層、核電荷數都相同時)電子層、核電荷數都相同時, ,電子數越多,原子電子數越多,原子半徑越大;反之,越小。半徑越大;反之,越小。1.下列微粒中,半徑大小排列順序正下列微粒中,半徑大小排列順序正確的是確的是( )AK+Ca2+Cl-S2- BCa2+K+S2-Cl-CCa2+K+Cl-S2- DS2-Cl-K+Ca2+C C課堂練習課堂練習課堂練習課堂練習2.2.具有相同電子層結構的三種微粒具有相同電子層結構的三種微粒A An+n+、B Bn-n-、C C,下列分析正確的是(下列分析正確的是( )A.A.原子序數關系:原子序數關系:C CB BA AB.B.微粒半徑關系:微粒半
5、徑關系: B Bn-n- A An+n+C.CC.C微粒是稀有氣體元素的原子微粒是稀有氣體元素的原子. .D.D.原子半徑關系是:原子半徑關系是:A AB BC CBCBC(二)電離能(閱讀課本(二)電離能(閱讀課本1717)1 1、概念、概念 氣態氣態電中性電中性基態原子基態原子失去失去一個電子一個電子轉化為轉化為氣態基態正離子所需要的能量叫做氣態基態正離子所需要的能量叫做第一電離能第一電離能。用符號用符號1 1表示,單位:表示,單位:kj/molkj/mol。 從一價氣態基態正離子中再失去一個電子從一價氣態基態正離子中再失去一個電子所需要的能量叫做第二電離能。符號所需要的能量叫做第二電離能
6、。符號2 2。思考與探究:思考與探究: 觀察下圖,總結第一電離能的變化律。觀察下圖,總結第一電離能的變化律。原子的第一電離能隨核電荷原子的第一電離能隨核電荷數遞增有什么規律?(同周數遞增有什么規律?(同周期、同主族)期、同主族)2 2、元素第一電離能的變化規律:、元素第一電離能的變化規律:(1)(1)同周期:同周期:a.a.從左到右呈現遞增趨勢(最小的是堿金屬,最從左到右呈現遞增趨勢(最小的是堿金屬,最大的是稀有氣體的元素;大的是稀有氣體的元素;(2)(2)同主族同主族:自上而下第一電離能逐漸減少。:自上而下第一電離能逐漸減少。3 3、電離能的意義:、電離能的意義:第第AA元素和第元素和第AA
7、元素的反常現象如何解釋?元素的反常現象如何解釋?b.b.第第AA元素元素 AA的元素;第的元素;第AA元素元素 AA元素元素 電離能是衡量氣態原子失去電子難易的物電離能是衡量氣態原子失去電子難易的物理量。元素的電離能越小,表示氣態時越容易理量。元素的電離能越小,表示氣態時越容易失去電子,即元素在氣態時的金屬性越強。失去電子,即元素在氣態時的金屬性越強。AA是半充滿、是半充滿、AA是全充滿結構。是全充滿結構。1.1.堿金屬的電離能與堿金屬的活潑性存在什么關系?堿金屬的電離能與堿金屬的活潑性存在什么關系?化合價是元素性質的一種體現。思考:為什么鈉元為什么鈉元素顯素顯1 1價,鎂元價,鎂元素顯素顯2
8、 2價,鋁元價,鋁元素顯素顯3 3價?元素價?元素化合價與原子結構化合價與原子結構有什么關系?有什么關系?堿金屬元素的第一電離能越小,金屬的活潑性就越強。堿金屬元素的第一電離能越小,金屬的活潑性就越強。學與問學與問交流與討論交流與討論2.2.為什么原子逐級電離能越來越大?這些數據跟鈉、為什么原子逐級電離能越來越大?這些數據跟鈉、鎂、鋁的化合價有何關系?鎂、鋁的化合價有何關系? 因為首先失去的電子是能量最高的電子,故因為首先失去的電子是能量最高的電子,故第一電離能較小,以后再失去電子都是能級較第一電離能較小,以后再失去電子都是能級較低的電子,所需要的能量多;同時失去電子后,低的電子,所需要的能量
9、多;同時失去電子后,陽離子所帶的正電荷對電子的引力更強,從而陽離子所帶的正電荷對電子的引力更強,從而電離能越來越大。電離能越來越大。方法方法 :看逐級電離能的突變。:看逐級電離能的突變。學與問學與問影響電離能大小的因素影響電離能大小的因素 原子核電荷原子核電荷(同一周期)即電子層數相同,(同一周期)即電子層數相同,核電荷數越多、半徑越小、核對外層電子引力核電荷數越多、半徑越小、核對外層電子引力越大、越不易失去電子,電離能越大。越大、越不易失去電子,電離能越大。 原子半徑原子半徑(同族元素)原子半徑越大、原(同族元素)原子半徑越大、原子核對外層電子的引力越小,越容易失去電子,子核對外層電子的引力
10、越小,越容易失去電子,電離能越小。電離能越小。 電子層結構電子層結構穩定的穩定的8 8電子結構(同周期末電子結構(同周期末層)電離能最大。層)電離能最大。 電電 離離 能能 增增 大大 電電 He 電電 離離 離離 能能 能能 減減 增增 小小 Cs 大大 電電 離離 能能 減減 小小元素電離能在周期表中的變化規律課堂練習課堂練習1.下列說法正確的是(下列說法正確的是( )A.第第3周期所含的元素中鈉的第一電離能最小周期所含的元素中鈉的第一電離能最小B.鋁的第一電離能比鎂的第一電離能大鋁的第一電離能比鎂的第一電離能大C.在所有元素中,氟的第一電離能最大在所有元素中,氟的第一電離能最大.D.鉀的
11、第一電離能比鎂的第一電離能大鉀的第一電離能比鎂的第一電離能大.A A反常現象反常現象最大的是稀有氣體的元素:最大的是稀有氣體的元素:HeHe從左到右呈現遞增趨勢(最小的是堿金屬)從左到右呈現遞增趨勢(最小的是堿金屬)K KNaNaMgMg課堂練習課堂練習2 2在下面的電子結構中在下面的電子結構中, ,第一電離能最小的第一電離能最小的 原子可能是原子可能是 ( ( ) ) A A ns ns2 2npnp3 3 B B ns ns2 2npnp5 5 C C ns ns2 2npnp4 4 D D ns ns2 2npnp6 6C3.3.下表是鋰的氣態原子失去核外不同電子所需的下表是鋰的氣態原子
12、失去核外不同電子所需的能量(能量(KJmolKJmol-1-1): :課堂練習課堂練習 通過上述信息和表中的數據分析為什么鋰原子失通過上述信息和表中的數據分析為什么鋰原子失去核外第二個電子時所需的能量要遠遠大于失去第去核外第二個電子時所需的能量要遠遠大于失去第一個電子所需的能量。一個電子所需的能量。 因為首先失去的電子是能量最高的電子,故第一電離能較小,以后再失去電子都是能級較低的電子,所需要的能量多;同時失去電子后,陽離子所帶的正電荷對電子的引力更強,從而電離能越來越大。(三)電負性(三)電負性(閱讀課本(閱讀課本1818)1 1、基本概念、基本概念化學鍵:化學鍵:元素相互化合,元素相互化合
13、,相鄰相鄰的原子之間產生的原子之間產生的的強烈強烈的化學作用力,叫做化學鍵。的化學作用力,叫做化學鍵。鍵合電子:鍵合電子:原子中用于形成化學鍵的電子稱為原子中用于形成化學鍵的電子稱為鍵合電子。鍵合電子。電負性:電負性:用來描述不同元素的原子對鍵合電用來描述不同元素的原子對鍵合電子的吸引力的大小電負性越大,對子的吸引力的大小電負性越大,對鍵合電子的吸引力越大。鍵合電子的吸引力越大。(電負性(電負性是相對值,沒單位)是相對值,沒單位)為了比較元素的為了比較元素的原子吸引電子能力原子吸引電子能力的大小,美國化學的大小,美國化學家鮑林于家鮑林于19321932年首年首先提出了用電負性先提出了用電負性來
14、衡量元素在化合來衡量元素在化合物中吸引電子的能物中吸引電子的能力。經計算確定氟力。經計算確定氟的電負性為的電負性為4.04.0,鋰的為鋰的為1.01.0,并以,并以此為標準確定其它此為標準確定其它與元素的電負性。與元素的電負性。鮑林鮑林L.Pauling1901-1994鮑林研究電負性的手搞鮑林研究電負性的手搞同一周期,主族元素的電負性從左同一周期,主族元素的電負性從左到右逐漸增大,表明其吸電子的能力到右逐漸增大,表明其吸電子的能力逐漸增強(非金屬性,氧化性增強)。逐漸增強(非金屬性,氧化性增強)。同一主族,元素的電負性從上到下同一主族,元素的電負性從上到下呈現減小的趨勢,表明其吸引電子的呈現
15、減小的趨勢,表明其吸引電子的能力逐漸減弱(金屬性、還原性增能力逐漸減弱(金屬性、還原性增強)。強)。電負性的規律電負性的規律電負性大小與金屬、非金屬的關系電負性大小與金屬、非金屬的關系電負性電負性1.81.8電負性電負性1.81.8電負性電負性1.81.8為為金屬金屬為為“類金屬類金屬”為為非金屬非金屬 以氟的電負性為以氟的電負性為4.04.0和鋰的電負性為和鋰的電負性為1.01.0作為相對標準,得出了各元素的電負性。作為相對標準,得出了各元素的電負性。 電負性的大小可以作為判斷金屬性和非金電負性的大小可以作為判斷金屬性和非金屬性強弱的尺度。屬性強弱的尺度。電負性的應用電負性的應用1 1判斷元
16、素的金屬性和非金屬性判斷元素的金屬性和非金屬性 金屬性元素的電負性一般在金屬性元素的電負性一般在1.81.8以下,非以下,非金屬性性元素一般在金屬性性元素一般在1.81.8以上。電負性最以上。電負性最大的元素是位于右上方的大的元素是位于右上方的F F,電負性最小,電負性最小的元素是位于左下方的的元素是位于左下方的FrFr(FrFr是放射性是放射性元素)元素). .3節2 2估計化學鍵的類型估計化學鍵的類型 在化合物中,可以根據電負性的差值在化合物中,可以根據電負性的差值大小,估計化學鍵的類型。大小,估計化學鍵的類型。 電負性差越大,離子性越強,一般說電負性差越大,離子性越強,一般說來,電負性差
17、大于來,電負性差大于1.71.7時,可以形成離子時,可以形成離子鍵,小于鍵,小于1.71.7時形成共價鍵。時形成共價鍵。電負性的應用電負性的應用一般認為:如果兩個成鍵元素的電負性相差大于一般認為:如果兩個成鍵元素的電負性相差大于1.71.7,它們通常形成離子鍵;如果兩個成鍵元素的,它們通常形成離子鍵;如果兩個成鍵元素的電負性相差小于電負性相差小于1.71.7,它們通常形成共價鍵。查閱,它們通常形成共價鍵。查閱下列元素的電負性數值,判斷:下列元素的電負性數值,判斷:NaFNaFAlClAlCl3 3NONOMgOMgOBeClBeCl2 2COCO2 2共價化合物(共價化合物( )離子化合物(離
18、子化合物( )課堂練習:課堂練習:1.下列左圖是根據數據制作的第三周期元素的下列左圖是根據數據制作的第三周期元素的電負性變化圖,請用類似的方法制作電負性變化圖,請用類似的方法制作IA、VIIA元素的電負性變化圖。元素的電負性變化圖。 2.2.在元素周期表中,某些主族元素與右下方的主族元在元素周期表中,某些主族元素與右下方的主族元素的性質有些相似,被稱為素的性質有些相似,被稱為“對角線規則對角線規則”。查閱資查閱資料,料,比較鋰和鎂在空氣中燃燒的產物比較鋰和鎂在空氣中燃燒的產物,鈹和鋁的氫氧鈹和鋁的氫氧化物的酸堿性化物的酸堿性以及以及硼和硅的含氧酸酸性的強弱硼和硅的含氧酸酸性的強弱,說明,說明對
19、角線規則,并用這些元素的電負性解釋對角線規則。對角線規則,并用這些元素的電負性解釋對角線規則。 解答:解答:LiLi、MgMg在空氣中燃燒的產物為在空氣中燃燒的產物為LiLi2 2O O、MgOMgO,Be(OH)Be(OH)2 2、Al(OH)Al(OH)3 3都是兩性氫氧化物,都是兩性氫氧化物,H H3 3BOBO3 3、H H2 2SiOSiO3 3都是弱酸。都是弱酸。這些都說明這些都說明“對角線規則對角線規則”的正確性。的正確性。 原子半徑原子半徑 、元素的金屬性和非、元素的金屬性和非金屬性、元素化合價、電離能和電金屬性、元素化合價、電離能和電負性等的周期性的變化。負性等的周期性的變化。元素周期律的內容包括:元素周期律的內容包括:小小 結結 根據周期律對角線規則,金屬鈹與鋁單質及其化根據周期律對角線規則,金屬鈹與鋁單質及其化合物的性質相似,又知合物的性質相似,又知AlClAlCl3 3熔沸點較低,易升華,熔沸點較低,易升華,試回答下列問題:試回答下列問題: (1)(1)寫出寫出
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 窗簾行業品牌形象塑造與傳播考核試卷
- 糧油企業生產流程標準化與質量控制考核試卷
- 木地板品牌國際化戰略與市場拓展考核試卷
- 彈射玩具產品創新設計思路與方法考核試卷
- 砼結構構件的預制件疲勞試驗考核試卷
- 紡織品的耐磨性與強度分析考核試卷
- 半導體照明器件的環境適應性測試標準考核試卷
- 線上線下融合的衛浴零售模式探索考核試卷
- 天津城建大學《形勢與政策(5)》2023-2024學年第二學期期末試卷
- 三門峽職業技術學院《基本樂理專業理論教學》2023-2024學年第二學期期末試卷
- 2025年裝維智企工程師(三級)復習模擬100題及答案
- 2024國家能源集團新疆哈密能源化工有限公司社會招聘110人筆試參考題庫附帶答案詳解
- 糖尿病飲食與護理
- 2025年天津市河東區中考一模歷史試題(原卷版+解析版)
- 停送電培訓課件
- 醫院培訓課件:《核心制度-護理值班和交接班制度》
- 解題秘籍05 圓的綜合問題(9種題型匯-總+專題訓練)(解析版)-2025年中考數學重難點突破
- 《基于STM32的智能水質檢測系統的設計》9400字(論文)
- 無線網絡施工方案
- 公路養護員工安全教育培訓
- 重慶大渡口區公安分局輔警招聘考試真題2024

評論
0/150
提交評論