


下載本文檔
版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
山西省臨汾市孫堡學校2023年高一化學月考試題含解析一、單選題(本大題共15個小題,每小題4分。在每小題給出的四個選項中,只有一項符合題目要求,共60分。)1.下列事實與濃硫酸表現出的性質(括號中)對應關系正確的是()A.濃硫酸可用來干燥某些氣體(不揮發性)B.在空氣中敞口久置的濃硫酸,溶液質量增大(脫水性)C.在加熱條件下銅與濃硫酸反應(氧化性、酸性)D.濃硫酸在白紙上書寫的字跡變黑(吸水性)參考答案:C試題分析:A、濃硫酸具有吸水性,可以用來干燥某些與濃硫酸不反應的酸性或中性氣體,如氫氣、二氧化碳等,表現的是濃硫酸的吸水性,錯誤;B、濃硫酸具有吸水性,則在空氣中敞口久置的濃硫酸,會吸收空氣中的水分而使溶液的質量增大,表現的是濃硫酸的吸水性,錯誤;C、濃硫酸具有強氧化性,則在加熱條件下銅與濃硫酸反應發生氧化還原反應生成硫酸銅和二氧化硫,表現的是濃硫酸的氧化性和酸性,正確;D、濃硫酸具有脫水性,能使有機物中的H、O元素以水的形式脫出,則濃硫酸在白紙上書寫的字跡變黑,表現的是濃硫酸的脫水性,錯誤。2.A元素原子的核電荷數為11,B元素原子的核電荷數為8,A與B化合形成化合物Z,下列說法中錯誤的是()A.A形成正一價陽離子B.Z一定能與水反應C.Z一定能與CO2反應D.Z一定是M2O型離子化合物參考答案:D解析A為Na,B為O,二者化合可以形成Na2O或Na2O2,Na2O、Na2O2均能與H2O或CO2反應。3.下列各組元素中,按最高正價遞增順序排列的是(
)A.Na、Mg、Al、S
B.C、N、O、FC.F、Cl、Br、I
D.Li、Na、K、Rb參考答案:A略4.下列敘述不正確的是A.13C和14C屬于同一元素,它們互為同位素B.1H和2H是不同的核素,它們的質子數相等C.14C和14N的質量數相等,它們的中子數不等D.6Li和7Li的電子數相等,中子數也相等參考答案:D試題分析:6Li和7Li的電子數相等,都為3,6Li中子數為3,7Li中子數為4,中子數不相等,D項錯誤。5.關于離子鍵、共價鍵的各種敘述中,下列說法中正確的是()A.在離子化合物里,只存在離子鍵,沒有共價鍵B.非極性鍵只存在于雙原子的單質分子(如Cl2)中C.在共價化合物分子內,一定不存在離子鍵D.由不同元素組成的多原子分子里,一定只存在極性鍵參考答案:C在離子化合物里,一定存在離子鍵,可以存在共價鍵,A錯誤;非極性鍵不只存在于雙原子的單質分子中,如是含有極性鍵和非極性鍵的化合物,B錯誤;在共價化合物分子內,一定不存在離子鍵,C正確;由不同元素組成的多原子分子里,不一定只存在極性鍵,如是含有極性鍵和非極性鍵的化合物,D錯誤;正確選項C。點睛:不同非金屬元素之間形成極性共價鍵,同種非金屬元素之間形成非極性共價鍵;由不同元素組成的多原子分子里,可能存在極性鍵、非極性鍵。
6.據國外資料報道,在獨居石(一種共生礦,化學成分為Ce、La、Nd等的磷酸鹽)中,查明有尚未命名的116、124、126號元素.判斷其中116號應位于周期表中的
()A.第六周期ⅣA族B.第七周期ⅥA族C.第七周期Ⅷ族
D.第八周期ⅥA族參考答案:B略7.短周期元素X、Y、Z、W、Q的原子序數依次增大,且只有一種金屬元素。X與W同一主族,Z元素原子半徑在短周期中最大(稀有氣體除外),W、Z之間與W、Q之間原子序數之差相等,五種元素原子最外層電子數之和為21。下列說法不正確的是(
)A.W的氧化物既可以和酸反應又可以和堿反應B.Y的氫化物與其最高價氧化物對應水化物相遇生成白煙...C.氣態氫化物的穩定性:Y>X>WD.Q可分別與X、Y、Z、W形成化學鍵類型相同的化合物參考答案:D短周期元素X、Y、Z、W、Q的原子序數依次增大,Z元素原子半徑在短周期中最大(稀有氣體除外),則Z為Na;Z、W、Q同周期,只有一種金屬元素,故W、Q最外層電子數都大于3,W、Z之間與W、Q之間原子序數之差相等,則W最外層電子數為4,Q最外層電子數為7,可推知W為Si、Q為Cl;X與W處于同一主族,則X為C元素;五種元素原子最外層電子數之和為21,則Y的最外層電子數=21-4-4-1-7=5,原子序數小于Na,故Y為N元素。A.二氧化硅屬于酸性氧化物,可以和堿反應,與酸一般不反應,可以與特殊的酸(氫氟酸)反應,故A正確;B.氨氣與硝酸反應生成硝酸銨白色固體,故B正確;C.元素的非金屬性越強,其氫化物越穩定,非金屬性:Y>X>W,則氣態氫化物的穩定性:Y>X>W,故C正確;D.Cl分別與C、N、Si形成的化合物含有共價鍵,與Na形成的NaCl含有離子鍵,化學鍵類型不相同,故D錯誤;故選D。點睛:本題考查結構性質位置關系應用,推斷元素是解題關鍵,注意充分利用非金屬元素最外層電子特點及W、Z之間與W、Q之間原子序數之差相等進行推斷。本題的易錯點是A。8.同溫同壓下,在兩個容積相同的容器中,一個盛有C2H4氣體,另一個盛有N2和CO的混合氣體。兩容器內的氣體一定具有相同的①分子數
②密度
③質量
④質子數
⑤原子數
⑥電子數A.①④⑥
B.①②⑤
C.③④⑥
D.①②③參考答案:D【詳解】①在同溫同壓下,相同體積的任何氣體含有相同的分子數,C2H4與N2和CO的總分子數目相同,故①正確;②N2和CO的相對分子質量都是28,故混合氣體平均相對分子質量為28,C2H4的相對分子質量為28,同溫同壓下,氣體密度之比等于相對分子質量之比,故兩容器內氣體的密度相等,故②正確;③CO、N2和C2H4的摩爾質量都是28g/mol,C2H4物質的量與N2和CO的總物質的量相等時,質量一定相等,故③正確;④CO分子中質子數為14,N2分子中質子數為14,C2H4分子中質子數為16,故C2H4分子數目與N2和CO的總分子數相等時,質子數一定不相等,故④錯誤;⑤CO、N2是雙原子分子、C2H4是6原子分子,C2H4分子數目與N2和CO的總分子數相等時,原子數一定不相等,故⑤錯誤;⑥CO分子中電子數為14,N2分子中電子數為14,C2H4分子中電子數為16,故C2H4分子數目與N2和CO的總分子數相等時,電子數一定不相等,故⑥錯誤;故答案選D。9.完全燃燒2mol某有機物,可以收集到標準狀況下89.6L的CO2和6mol的H2O,同時消耗6molO2,試推斷該有機物的分子式是()A.C2H4B.C2H4OC.C2H6D.C2H6O參考答案:D【考點】有關有機物分子式確定的計算.【分析】先計算出二氧化碳的物質的量,再根據C、H原子守恒確定有機物分子中C、H原子數目,最后結合耗氧量確定有機物分子中O原子數目.【解答】解:標況下89.6L二氧化碳的物質的量為:=4mol,完全燃燒2mol某有機物,生成4molCO2和6molH2O,同時消耗6molO2,則有機物分子中C原子數目==2、H原子數目==6,設有機物分子式為C2H6On,根據耗氧量,則:2mol×(2+﹣)=6,解得n=1,故該有機物的分子式為C2H6O,故選D.10.用NA表示阿伏加德羅常數的值,下列敘述正確的是
A.含有NA個氦原子的氦氣在標準狀況下的體積約為11.2LB.25℃,1.01×105Pa,64gSO2中含有的原子數為3NAC.在常溫常壓下,11.2LCl2含有的分子數為0.5NAD.標準狀況下,11.2LH2O含有的分子數為0.5NA參考答案:B略11.下列電離方程式中正確的是(
)
A.H2SO4
==H2++SO42-
B.Ca(OH)2
==Ca2++(OH)2-C.AlCl3==Al+3+3Cl-1
D.Fe2(SO4)3
==2Fe3++3SO42-參考答案:D略12.下述實驗能達到預期目的的是
(
)編號實驗內容實驗目的A將SO2通入酸性KMnO4溶液中,使其褪色。證明SO2具有漂白性B將Cl2通入NaBr溶液中比較Cl2與Br2的氧化性強弱C除去CO2中混有少量的CO,點燃燃燒除去CO雜質D鹽酸與Na2CO3反應生成CO2證明非金屬性:Cl>C參考答案:B略13.已知1.505×1023個X氣體分子的質量為8g,則X氣體的摩爾質量是A.16g
B.32g
C.64g/mol
D.32g/mol參考答案:D略14.用式量為43的烷基取代甲苯苯環上的一個氫原子,所得芳香烴產物的種類數為:(A)3
(B)
4
(C)5
(D)6參考答案:D15.取ag某物質在氧氣中完全燃燒,將其產物跟足量的過氧化鈉固體完全反應,反應后固體的質量恰好也增加了ag。下列物質中不能滿足上述結果的是A.H2
B.CO
C.C6H12O6D.C12H22O11參考答案:D略二、實驗題(本題包括1個小題,共10分)16.某學習小組的同學在實驗室研究Na2CO3與NaHCO3的性質。實驗I:(1)產生氣體的速率A___
B(填“>”或“<”或“=”),結合化學用語說明原因_________。(2)產生氣體的體積A___
B
(填“>"
或“<”或“=”),標準狀況下,A燒杯中產生氣體的體積為____L。(3)任意寫出一種將NaHCO3轉變為Na2CO3的方法______________(用化學方程式表示)。實驗Ⅱ:1mL0.1mol/LNaHCO3溶液與lmL.0.01mol/LCa(OH)2溶液混合產生CaCO3白色沉淀。(4)同學們設計了如下實驗方案,驗證上述反應過程,請將方案補充完整:實驗步驟實驗現象i.取lmL0.1mol/LNaHCO3溶液。向其中加入1mL
0.0
1mol/L
CaCl2
溶液無明顯現象ⅱ.向上述溶液中滴加______________________
參考答案:(1)>
Na2CO3與酸反應經歷兩步,而NaHCO3只有一步,因此A中產生氣體速率快
(2)=
2.24
(3)2NaHCO3Na2CO3+H2O+CO2↑等
(4)Ca(OH)2
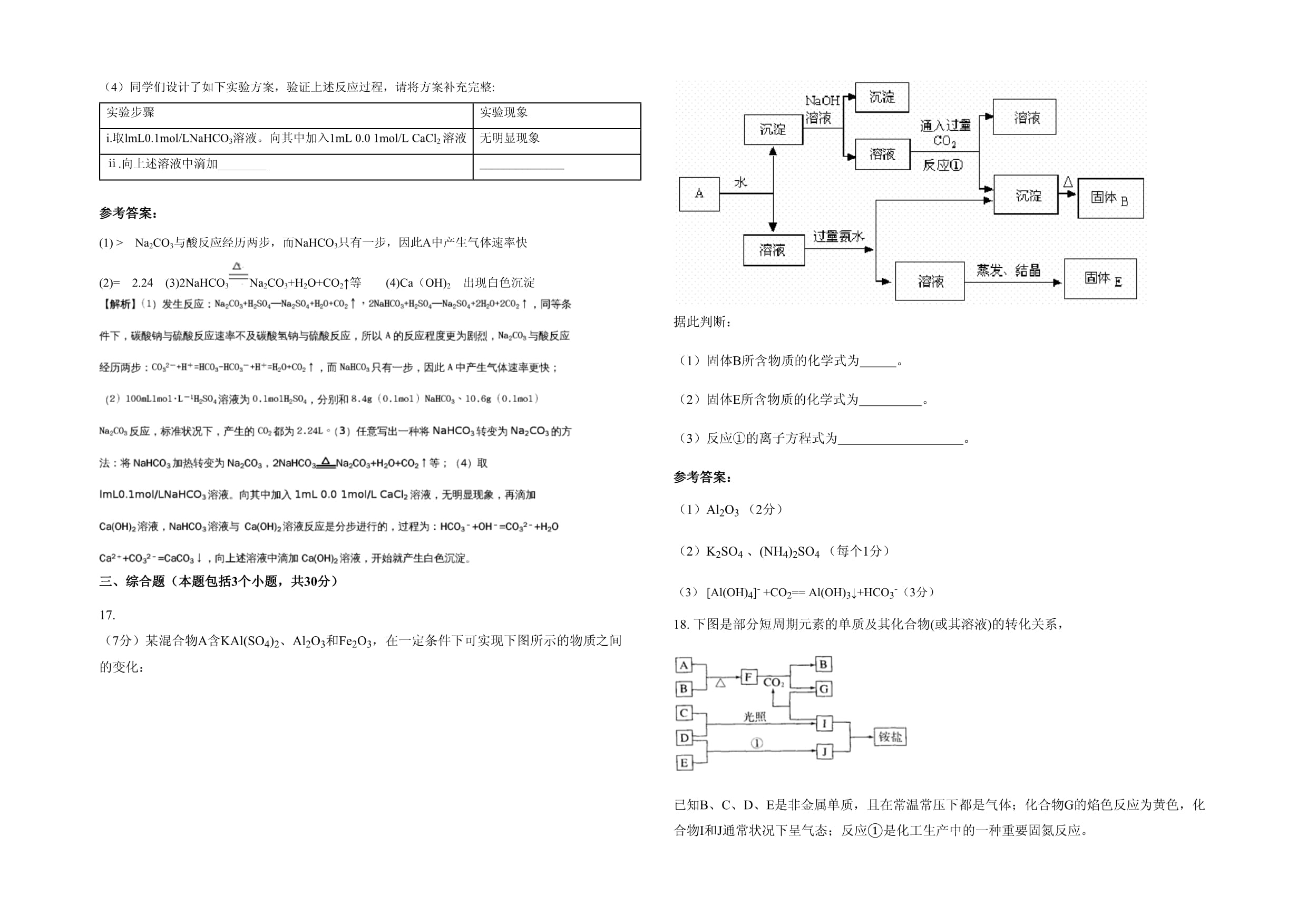
出現白色沉淀三、綜合題(本題包括3個小題,共30分)17.(7分)某混合物A含KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現下圖所示的物質之間的變化:
據此判斷:(1)固體B所含物質的化學式為
。(2)固體E所含物質的化學式為
。(3)反應①的離子方程式為
。參考答案:(1)Al2O3(2分)(2)K2SO4、(NH4)2SO4(每個1分)(3)[Al(OH)4]-+CO2==Al(OH)3↓+HCO3-(3分)
18.下圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系,已知B、C、D、E是非金屬單質,且在常溫常壓下都是氣體;化合物G的焰色反應為黃色,化合物I和J通常狀況下呈氣態;反應①是化工生產中的一種重要固氮反應。請回答下列問題:(1)I與J反應生成的銨鹽中存在的化學鍵的類型
;(2)A~J物質中屬于離子化合物的是
;(書寫化學式)(3)F和CO2反應的化學方程式:
;(4)寫出化合物G與I溶液完全反應的離子方程式:
。參考答案:略19.A、B、C、D、E、F是原子序數依次增大的六種短周期元素。其中A元素的原子半徑是短周期元素中最小的,D元素的原子半徑是短周期元素中最大的(不包括稀有氣體元素);B元素的最外層電子數是其電子層數的兩倍;C元素原子的最外層電子數是次外層電子數為3倍;E元素是地殼中含量最高的金屬元素;F元素原子的最外層電子數等于其次外層電子數的一半。
回答下列問題(答題時涉及化學式的用具體元素符號表示):
(1)C元素的元素名稱是
,F元素在元素周期表中的位置
(2)由A、B兩種元素形成的,相對分子質量等于72的化合物存在三種同分異構體。請寫出它們的結構簡式
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 濰坊理工學院《電算化財務管理》2023-2024學年第二學期期末試卷
- 中國地質大學(北京)《宋詞研究》2023-2024學年第二學期期末試卷
- 東莞職業技術學院《國際知識產權法(B)》2023-2024學年第二學期期末試卷
- 終身教育平臺建設方案
- 蘭州博文科技學院《化工過程安全》2023-2024學年第二學期期末試卷
- 七臺河職業學院《中學體育教學技能訓練》2023-2024學年第二學期期末試卷
- 浙江國際海運職業技術學院《矩陣理論與應用》2023-2024學年第二學期期末試卷
- 商丘醫學高等專科學校《工控軟件基礎》2023-2024學年第二學期期末試卷
- 2025標準工業廠房租賃合同范本
- 心理健康課件小學逐字稿
- (廣東二模)2025年廣東省高三高考模擬測試(二)歷史試卷(含答案)
- 2025湖南建投集團春季校園招聘239人筆試參考題庫附帶答案詳解
- 2025-2030全球冰雪產業經營效益與發展投資策略建議研究報告
- 反邪教測試題及答案
- 業務合規制度培訓
- GB/T 14601-2025電子特氣氨
- 民航安全檢查掌握人身檢查課件
- 湖北省武漢第二中學2025屆高三3月高考模擬考試數學試題試卷
- 《集中用餐單位落實食品安全主體責任監督管理規定》解讀與培訓
- 2025年上半年生態環境部信息中心招聘工作人員22人重點基礎提升(共500題)附帶答案詳解
- 保安公司組織架構、崗位制度及保安管理制度

評論
0/150
提交評論