



版權說明:本文檔由用戶提供并上傳,收益歸屬內(nèi)容提供方,若內(nèi)容存在侵權,請進行舉報或認領
文檔簡介
1、第一章第一章 緒緒 論論第一節(jié):有機化合物和有機化學第一節(jié):有機化合物和有機化學1.1 有機化合物(有機化合物(Organic compounds) 是:是: 含碳化合物含碳化合物 (石墨烯石墨烯)1、烴及其衍生物、烴及其衍生物烴烴:含有碳元素、氫元素的碳氫化合物含有碳元素、氫元素的碳氫化合物(Hydrocarbon) 例如:例如:CH4CH3CH2CH2CH3CH2CH2CH2CHCHCH2CH3,烴的衍生物烴的衍生物:烴分子中還含有:烴分子中還含有 O、N、S、P、F、Cl、 Br、I、Si,B 等元素的化合物等元素的化合物例如:例如:,YY=S O3 H, C l, N O2, C O2
2、 H, O H, N H2(P h)3 PF2 CC F2 C Cl4, C H3C H2O H, CH3COCH3,有機化合物:有機化合物:烴(碳氫化物)及其衍生物烴(碳氫化物)及其衍生物 有機金屬化合物有機金屬化合物(organometallic compounds): 含有:碳含有:碳-金屬鍵(金屬鍵(C- MC- M)的化合物)的化合物 C - M C - M 鍵:極性共價鍵、離子鍵鍵:極性共價鍵、離子鍵? M M:LiLi,MgMg,ZnZn,F(xiàn)eFe,Sn,Cu,Cd,Hg,Pb Sn,Cu,Cd,Hg,Pb 例如:例如:H-CH3CH2CH2CH2Li,MgBrPb(C2H5)4
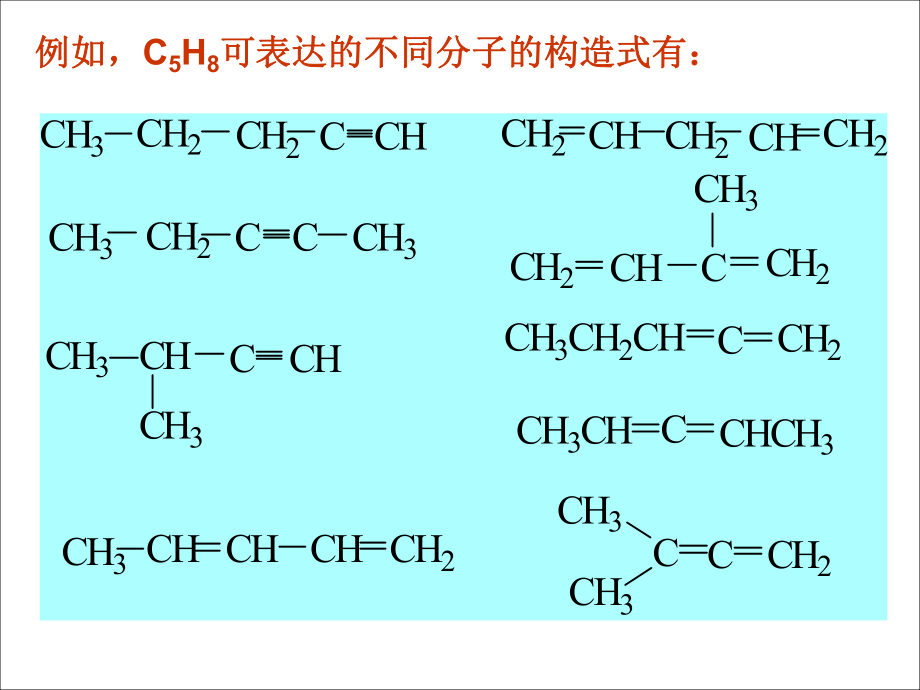
3、,Fe2 2、有機化合物的特點(共性)有機化合物的特點(共性) 分子中原子之間以共價鍵相連分子中原子之間以共價鍵相連. 例如:例如: 分子中的分子中的C、O、N等原子可以與其他非金屬原子以等原子可以與其他非金屬原子以單鍵、雙鍵、三鍵的形式相連。所以:有機化合物的單鍵、雙鍵、三鍵的形式相連。所以:有機化合物的同分異構現(xiàn)象普遍,數(shù)量龐大,結構復雜。同分異構現(xiàn)象普遍,數(shù)量龐大,結構復雜。 現(xiàn)在有機化合物大概有多少?(種類與數(shù)量)現(xiàn)在有機化合物大概有多少?(種類與數(shù)量)CCCHHHHHHHHHHCClClClHCCOHHHHHCCHHHHH例如,例如,C5H8可表達的不同分子的構造式有:可表達的不同分
4、子的構造式有:CH3CH2CH2CH2C CHCHCH3CH2CH2CH2CH2CCCCHCHCHCHCH3CH3CH3CH3CH3CCCCCCHCH3CHCHCHCH2CH2CH2CH2CH3CH2CHCH3CHCH3CH3CCH2CH2CH2CCH3CH3CH3CH3CH2H2CH2CCHCHH2CCHHCHCCH3H2CHCCCH2CH2CCHCH2CH3HCCHCCH3CH3CH2CCCHCH3CH3CHCH2CH2CHH2CCH2CH2H2CH2CCCH2CH2CCH2CH2HH2CH2CCHHCCH2H2CHCCH2CH2CCHHCHCH2CCHCH2CCCHCH3CH2HH:絕大
5、多數(shù)有機化合物的水溶性不好,易燃、絕大多數(shù)有機化合物的水溶性不好,易燃、可燃;相對分子質量較小的液體有機化合物揮發(fā)可燃;相對分子質量較小的液體有機化合物揮發(fā)性較大;固體有機化合物的強度較小,熔點較低性較大;固體有機化合物的強度較小,熔點較低(分子晶體一般(分子晶體一般300),熱穩(wěn)定性不好熱穩(wěn)定性不好(分解溫度一般(分解溫度一般Z )碳鹵鍵的極化度順序:碳鹵鍵的極化度順序: CI CBr CCl CF補充內(nèi)容:補充內(nèi)容: 誘導效應誘導效應1、共價鍵極性的變化在鏈上的傳遞、共價鍵極性的變化在鏈上的傳遞-誘導效應(誘導效應( inductive effectinductive effect I 效
6、應效應) 在分子中由極性共價鍵的形成及由其導致在分子中由極性共價鍵的形成及由其導致的沿價鍵鏈傳遞的電子偏移(產(chǎn)生鍵的極的沿價鍵鏈傳遞的電子偏移(產(chǎn)生鍵的極化)現(xiàn)象,稱為誘導效應化)現(xiàn)象,稱為誘導效應。H3CH2CH2CCl+0.002+0.028+0.681- 0.713 在分子、離子或自由基中:在分子、離子或自由基中:電負性較大的原子電負性較大的原子(官能團)有吸引(拉)電子的作用,具有(官能團)有吸引(拉)電子的作用,具有 吸電子的吸電子的 誘導效應(誘導效應(-I 效應)效應): 電負性較小的原子(官能團)有提供(推)電子電負性較小的原子(官能團)有提供(推)電子的作用,具有的作用,具有
7、 供電子誘導效應(供電子誘導效應(+I 效應):效應):CH3CHCH2+I-ICH3CH2Cl+I-I2、靜態(tài)誘導效應:靜態(tài)誘導效應: 由分子中固有的極性鍵所表現(xiàn)出的誘導效應,稱為靜態(tài)誘由分子中固有的極性鍵所表現(xiàn)出的誘導效應,稱為靜態(tài)誘導效應。導效應。 3、 動態(tài)誘導效應:動態(tài)誘導效應: 在外界電場(極性試劑、極性溶劑)的影響下,或在在外界電場(極性試劑、極性溶劑)的影響下,或在反應過程中,分子或活潑中間體產(chǎn)生了鍵的極化,由此而反應過程中,分子或活潑中間體產(chǎn)生了鍵的極化,由此而導致的誘導效應稱為動態(tài)誘導效應。導致的誘導效應稱為動態(tài)誘導效應。CH3ClCHHHClCH3CH2CH2+I-I+I
8、HCH2CH2+- 分子(離子、自由基)中價鍵電子偏移的描述分子(離子、自由基)中價鍵電子偏移的描述 電子的偏移電子的偏移:短線上的箭頭表示短線上的箭頭表示鍵電子沿鍵電子沿鍵軸鍵軸移動的方向移動的方向鍵電子的偏移:鍵電子的偏移:彎箭頭表示彎箭頭表示在在spsp2 2雜化平面上下兩側的雜化平面上下兩側的鍵電子向電負性較鍵電子向電負性較大的原子大的原子一方一方移動移動CHHHClHHCO4、原子或基團的誘導效應強弱的比較原子或基團的誘導效應強弱的比較 (相對標準相對標準) 醋酸在水中的電離平衡為:醋酸在水中的電離平衡為: 如果以不同的原子或基團取代如果以不同的原子或基團取代 CH3中的一個中的一個
9、H,便得,便得到了不同的取代乙酸到了不同的取代乙酸: H3CCO+ H2OOHH3CCOO+ H+3O_Ka =CH3CO2-H2OH3CCO2HH+3OpKa = -lgKaH2CCOOHY 如果取代基如果取代基 Y 有有-I 效應,則其吸電子作用傳遞的結效應,則其吸電子作用傳遞的結果會導致果會導致 O H 鍵的極性增大鍵的極性增大,因此而有利于因此而有利于O H 解解離出離出 H+, 即即 Ka 增大增大(pKa變小變小),則該取代乙酸的酸性增,則該取代乙酸的酸性增強。強。 Y 的的 I 效應增強,則效應增強,則 YCH2COOH 的酸性增強。的酸性增強。 可以通過對不同的取代乙酸(可以通
10、過對不同的取代乙酸( YCH2COOH) 的酸的酸性強度的測定,來判斷性強度的測定,來判斷 Y 的的 I 效應的強弱。效應的強弱。 有結論:有結論:H2CCOOHYY的-I增加,酸性增強H2CCOOHYY的+I增加,酸性減弱 (測定的結果是)(測定的結果是)原子或基團的吸電子能力順序為:原子或基團的吸電子能力順序為: -N+R3-NO2-CN-COOHCOOR C=O-F-Cl -Br-I-OCH3-OH-C6H5-CH=CH2-H-CH3 -CH2CH3-CH(CH3)2-C(CH3)3 排在排在 H 之前者為之前者為吸電子基(有相對的吸電子基(有相對的 -I效應)效應) 排在排在 H 后面
11、的為后面的為供電子基(有相對的供電子基(有相對的 +I效應)效應) 帶有正電荷的基為強帶有正電荷的基為強 I 效應基效應基 帶有負電荷的基為強帶有負電荷的基為強 +I 效應基效應基 NR3N+OO_,_O 基團的吸電子或供電子作用是相對的:基團的吸電子或供電子作用是相對的: CH3H2CCHCH3ClH2CCHH2CCH是吸電子基H2CCH是供電子基NO2苯環(huán)是吸電子基苯環(huán)是供電子基第四節(jié)第四節(jié) 有機反應中的共價鍵斷裂有機反應中的共價鍵斷裂4.1 共價鍵的斷裂方式和反應類型共價鍵的斷裂方式和反應類型1、共價鍵的平均斷裂、共價鍵的平均斷裂均裂(均裂(homolysis) 生成自由基(生成自由基(
12、free radical),導致自由基型導致自由基型 反應發(fā)生。反應發(fā)生。+A B:or hvAB.2、共價鍵的異裂(、共價鍵的異裂(heterolysis)生成正離子和負離子生成正離子和負離子,導致離子型反應發(fā)生。導致離子型反應發(fā)生。共價鍵異裂需極性條件:共價鍵異裂需極性條件: 極性溶劑極性溶劑 極性試劑極性試劑 催化劑催化劑A B:ABAB+:+_:_+3、協(xié)同反應(周環(huán)反應協(xié)同反應(周環(huán)反應 第第18章)章) 反應過程中,化學鍵斷裂與生成同時發(fā)生(不形成反應過程中,化學鍵斷裂與生成同時發(fā)生(不形成自由基,正、負離子),并經(jīng)過一個環(huán)狀自由基,正、負離子),并經(jīng)過一個環(huán)狀 過渡態(tài)。過渡態(tài)。4
13、.2 有機化學反應中的活潑中間體有機化學反應中的活潑中間體 碳自由基(碳自由基(free radical) 、碳正離子、碳正離子(carbocation)、 碳負離子碳負離子(carbanion) YCCC+.:Y+C:YY自由基碳正離子碳負離子碳正離子碳正離子 、碳自由基碳自由基 一般為平面構型(一般為平面構型(sp2 雜化)雜化)碳負離子碳負離子 一般為四面體構型(一般為四面體構型(sp3雜化)雜化).CCH3CCH3CH3CH3HHHHFFF+CCH3CH3.C.(CH3)3C+(sp2)(CH3)2CH (sp2)(sp3)CF3(sp3)4.3 碳正離子及碳自由基的(熱力學)穩(wěn)定性碳
14、正離子及碳自由基的(熱力學)穩(wěn)定性 (CH3)3C+(CH3)2CH+CH3CH2+CH3+ (CH3)3C(CH3)2CHCH3CH2CH3 CH 鍵解離能鍵解離能(kJ.mol-1):(CH3)3C-H ,(CH3)2CH-H, CH3CH2-H, CH3-H 380 397 410 435自由基生成熱自由基生成熱(Hf /kJ.mol-1) : CH3CH2CH2CH2, CH3CH2CHCH3, (CH3)3C 67 55 38.碳自由基的電離勢碳自由基的電離勢((kJ.mol-1)R R+ + e (CH3)3C, (CH3)2CH, CH3CH2, CH3 715 761 845
15、958烷烴按下式生成碳正離子時:烷烴按下式生成碳正離子時: .H+R-HR.-eR+R的內(nèi)能大小為:(CH3)3C+(CH3)2CH+CH3CH2+ 乙酸乙酸 苯酚苯酚pKa: 1.2 4.74 10取代基:取代基: 甲磺酰基甲磺酰基 乙酰基乙酰基 苯基苯基 取代基的吸電子能力增加強,則酸性增強取代基的吸電子能力增加強,則酸性增強負離子的穩(wěn)定性還受中心原子的雜化狀態(tài)和溶劑種類影響。負離子的穩(wěn)定性還受中心原子的雜化狀態(tài)和溶劑種類影響。5.3 5.3 路易斯的電子理論路易斯的電子理論路易斯(Lewis)在20世紀30年代提出了更廣泛的酸堿定義: 酸是電子對的接受體接受體,堿是電子對的給予體給予體,
16、路易斯酸堿理論亦稱電子酸堿理論電子酸堿理論。 路易斯酸的類型:路易斯酸的類型:中心原子缺電子或有空軌道中心原子缺電子或有空軌道 如:BF3、AlCl3、SnCl4、ZnCl2 和 FeCl3等;正離子正離子:Li+、Ag+ 和 Cu+ 等金屬離子及R+(碳正離子)、Br+、NO2+ 和 H+等。H+、BF3、AlCl3、ZnCl2等在有機反應中常作為催化劑。路易斯堿主要有下列幾種類型:路易斯堿主要有下列幾種類型: . .具有未共用電子對未共用電子對的化合物,如NH3、RNH2(胺) . . . .ROH(醇)、ROR(醚)、R2C=O(酮)、RSH(硫醇)負離子負離子,如R-(碳負離子)、OH
17、-、RO-、SH-;烯、炔及芳香化合物烯、炔及芳香化合物等。 路易斯堿路易斯堿都是富電子富電子的,在化學反應過程中以給出電子或共用電子的方式和其他分子或離子中缺電子部分結合生成共價鍵,因此稱為親核試劑親核試劑(nucleophile)。 路易斯酸路易斯酸一般都是缺電子缺電子的,在反應過程中傾向于進攻反應物中富電子的部分,對電子具有親合力,稱為親電試劑親電試劑(electrophile)。 用用彎箭頭彎箭頭表示反應中的表示反應中的電子對的移動電子對的移動,箭頭箭頭由共價鍵或未共用電子對開始,終點為反應物中由共價鍵或未共用電子對開始,終點為反應物中缺電子的部分,表示缺電子的部分,表示電子轉移的方向
18、電子轉移的方向。 在下面羧酸與堿的反應中,一個彎箭頭一個彎箭頭由氫氧負離子中的未共用電子對處開始,終點為羧酸中缺電子的氫,反應后形成水的 OH 鍵; 另一個彎箭頭另一個彎箭頭表示羧酸的 OH 鍵異裂,該共價鍵的一對電子轉移到氧原子上,OH 鍵異裂,同時形成羧基負離子。第六節(jié)第六節(jié) 有機化合物的結構測定有機化合物的結構測定 以后集中講述以后集中講述提示:提示: 本章基本內(nèi)容:本章基本內(nèi)容: 1 共價鍵及其屬性共價鍵及其屬性 2 共價鍵斷裂、反應類型共價鍵斷裂、反應類型 3 活性中間體活性中間體 4 有機反應的酸堿概念有機反應的酸堿概念 5 有機化合物的分類有機化合物的分類本章重點:本章重點: 不同雜化碳之間形成的共價鍵不同雜化碳之間形成的共價鍵本章難點:本章難點:誘導效應(補充內(nèi)容)誘導效應
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯(lián)系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網(wǎng)頁內(nèi)容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經(jīng)權益所有人同意不得將文件中的內(nèi)容挪作商業(yè)或盈利用途。
- 5. 人人文庫網(wǎng)僅提供信息存儲空間,僅對用戶上傳內(nèi)容的表現(xiàn)方式做保護處理,對用戶上傳分享的文檔內(nèi)容本身不做任何修改或編輯,并不能對任何下載內(nèi)容負責。
- 6. 下載文件中如有侵權或不適當內(nèi)容,請與我們聯(lián)系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 燒烤業(yè)網(wǎng)紅店區(qū)域代理合作協(xié)議范本
- 能源監(jiān)測數(shù)據(jù)實時采集與處理協(xié)議
- 社區(qū)共享廚房加盟店加盟店市場調研與競爭分析協(xié)議
- 資產(chǎn)評估機構合伙人合作協(xié)議及保密責任承諾書
- 建筑節(jié)能改造工程全過程審計監(jiān)管協(xié)議
- 2025年中國白皮杉醇行業(yè)市場規(guī)模調研及投資前景研究分析報告
- 生物農(nóng)藥田間試驗技術支持與成果轉化協(xié)議
- 網(wǎng)絡數(shù)據(jù)恢復硬盤租賃與數(shù)據(jù)恢復技術培訓合同
- 跨境電商平臺客服外包及售后服務合同
- 智能倉儲物流標準補充協(xié)議
- 輻射及其安全防護(共38張PPT)
- 初三中考宣誓誓詞82060
- 觸電事故桌面推演方案
- 護理風險評估及填寫要求
- 《中興通訊績效管理制度》-人事制度表格【管理資料】
- 微邦生物技術生活污水處理中的應用
- 鐵路工務技術手冊
- (完整版)硬件測試規(guī)范
- 2006年工資標準及套改對應表
- DBJ∕T 13-183-2014 基樁豎向承載力自平衡法靜載試驗技術規(guī)程
- 張雙樓煤礦安全評價報告(出版稿10.14)

評論
0/150
提交評論