



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
1、第三章第三章 化學反應速率與化學平衡化學反應速率與化學平衡3.1 化學反應速率理論簡介化學反應速率理論簡介3.2 影響化學反應速率的主要因素影響化學反應速率的主要因素3.3 化學平衡化學平衡3.4 化學平衡的移動化學平衡的移動學學 習習 要要 點點 理解反應速率的概念、表示方法和反應速率方理解反應速率的概念、表示方法和反應速率方程;程; 理解并掌握濃度(或分壓)、溫度、催化劑對理解并掌握濃度(或分壓)、溫度、催化劑對化學反應速率的影響并會應用;化學反應速率的影響并會應用;掌握濃度、壓力、溫度對化學平衡的影響。掌握濃度、壓力、溫度對化學平衡的影響。 3.1 化學反應速率化學反應速率 反應速率:指
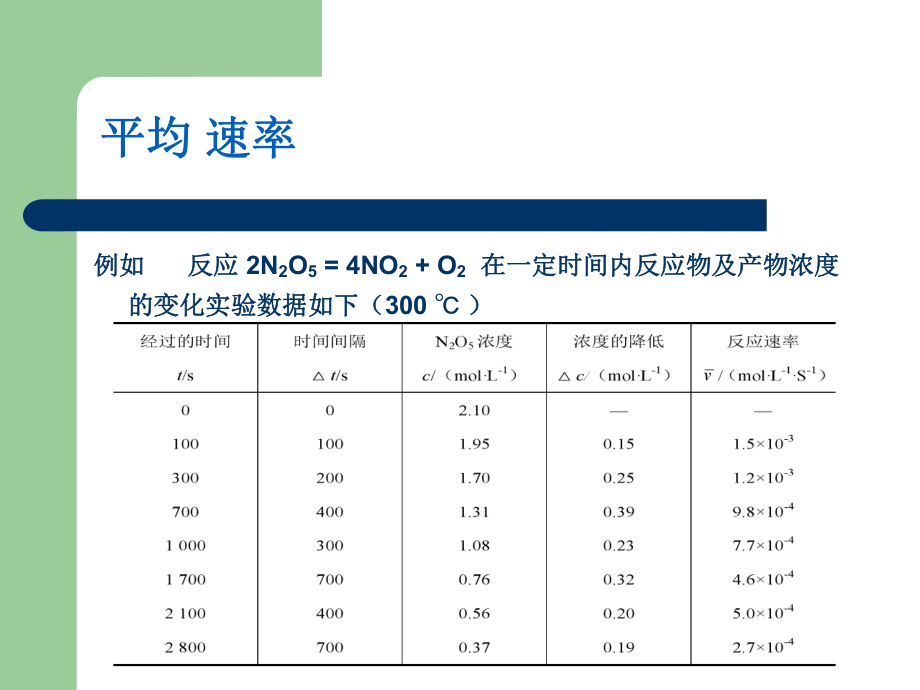
2、給定條件下反應物通過化學反反應速率:指給定條件下反應物通過化學反應轉化為產物的速率,常用單位時間內反應物濃應轉化為產物的速率,常用單位時間內反應物濃度的減少或者產物濃度的增加來表示。度的減少或者產物濃度的增加來表示。 濃度常用molL-1,時間常用s,min,h。 反應速率有平均速率和瞬時速率兩種表示方法。1(mol L )( )( )vs濃度變化反應速率變化所需時間平均平均 速率速率例如例如 反應反應 2N2O5 = 4NO2 + O2 在一定時間內反應物及產物濃度在一定時間內反應物及產物濃度的變化實驗數據如下(的變化實驗數據如下(300 )前前100s 內反應的平均速率為:內反應的平均速率
3、為: 只是0100 s內N2O5的分解反應的平均速率。每個時間間隔速率都不一樣,而且在每個時間間隔里,任何時間內的速率都是不一樣的。 3.1.5 反應速率理論簡介反應速率理論簡介1. 碰撞理論碰撞理論首要條件首要條件-有效碰撞。有效碰撞。(1) 能量因素能量因素 活化分子活化分子: 那些具有足夠高的能量、那些具有足夠高的能量、能夠發生有效碰撞的分子能夠發生有效碰撞的分子活化能活化能 : 要使普通分子成為活要使普通分子成為活化分子所需的最小能量,用化分子所需的最小能量,用Ea表示。即要使表示。即要使1mol具有平均能具有平均能量的分子轉化成活化分子所需量的分子轉化成活化分子所需吸收的最低能量。吸
4、收的最低能量。 氣體分子的能量分布曲線EkEc具有一定能量的分子百分數E 為此,我們可以作出氣體分子能量分布的示意圖:曲線下的面積表示氣體分子百分數的總和為100%。斜線下的面積表示活化分子所占的百分數 Ek為氣體分子的平均能量,Ec為活化分子的平均能量活化能活化能。用符號Ea表示,單位kJ/mol。即:E Ea a = = E Ec c - - E Ek k 顯然,反應的活化能越小,活化分子所占的百分數越多,有效碰撞次數越多,反應速度越快;活化能越大,則反應速度越慢。 在一定溫度下,任何一個反應都有特定的活化能,一般化學反應活化能約在40400kJ/mol,之間,活化能小于40kJ/mol屬
5、于快反應,活化能大于400kJ/mol屬于慢反應。方位因素方位因素 碰撞理論,較成碰撞理論,較成功地解釋了反應物濃功地解釋了反應物濃度、反應溫度對反應度、反應溫度對反應速率的影響等,但也速率的影響等,但也存在一些局限性。存在一些局限性。 合適合適方向方向不合適的不合適的方向方向 化學反應的方位因素 2.過渡狀態理論過渡狀態理論 A+BCABC 過渡態過渡態AB+C快快慢慢 化學反應不是通過反應物分子的簡單碰化學反應不是通過反應物分子的簡單碰撞而完成的撞而完成的, , 反應物分子在相互接近時必須先反應物分子在相互接近時必須先經過一個中間過渡狀態經過一個中間過渡狀態, , 即形成一種活化配合即形成
6、一種活化配合物物, , 然后再轉化為產物。然后再轉化為產物。 反應的活化能就是翻反應的活化能就是翻過能壘過能壘Ea所需的能量,所需的能量,它等于過渡態和反應物的它等于過渡態和反應物的勢能差。即:勢能差。即: Ea正正 = E過渡態過渡態E始態始態 由于正、逆反應有相由于正、逆反應有相同的活化配合物,同樣,同的活化配合物,同樣,過渡態與產物的勢能差為過渡態與產物的勢能差為逆反應的活化能。即:逆反應的活化能。即: Ea逆逆 = E過渡態過渡態E終態終態2.2.過渡狀態理論過渡狀態理論 兩種化學反應速率理論的對比兩種化學反應速率理論的對比3.2 影響化學反應速率的因素影響化學反應速率的因素一一、濃度
7、對反應速率的影響濃度對反應速率的影響 當反應物濃度增大時,單位體積內分子總數增加,當反應物濃度增大時,單位體積內分子總數增加,活化分子的數目相應也增多,單位體積、單位時間內活化分子的數目相應也增多,單位體積、單位時間內的分子有效碰撞的總數也就增多,因而反應速率加快。的分子有效碰撞的總數也就增多,因而反應速率加快。 二、溫度對化學反應速率的影響二、溫度對化學反應速率的影響溫度升高時,絕大多數反應的速率都會加快。溫度升高時,絕大多數反應的速率都會加快。溫度升高使反應速率顯著提高的原因是:溫度升高使反應速率顯著提高的原因是: 活化分子百分數增大。活化分子百分數增大。 分子運動速率加快分子運動速率加快
8、, ,反應物分子間碰撞頻率增反應物分子間碰撞頻率增大。大。催化劑對反應速率的影響催化劑對反應速率的影響 凡能改變反應速度的而本身的組成和質量在反應前凡能改變反應速度的而本身的組成和質量在反應前后保持不變的物質叫做催化劑后保持不變的物質叫做催化劑。加快反應速度的催化劑叫正催化劑,減慢反應速度的催化劑叫負催化劑。二、原因原因: 催化劑為什么能改變化學反應速度呢?催化劑之所以能加速反應。是因為它參與了變化過程,改變了原來反應的途徑,降低了反應的活化能。 如:A+BAB反應,無催化劑存在時按途徑I,活化能為Ea。有催化劑K存在時,反應機理發生了變化,反應按照途徑II分兩步進行。A+KAK 活化能為E1
9、,AK+BAB+K 活化能為E2。由于E1、E2均小于Ea,所以反應速度加快。1. 催化劑只能改變反應速率,不能改變反應方向。催化劑只能改變反應速率,不能改變反應方向。2. 催化劑只能縮短可逆反應達到平衡的時間,不催化劑只能縮短可逆反應達到平衡的時間,不能改變平衡狀態。能改變平衡狀態。3. 催化劑參與反應過程,改變反應途徑,降低反催化劑參與反應過程,改變反應途徑,降低反應活化能。應活化能。 4. 催化劑有選擇性。催化劑有選擇性。催化作用的特征催化作用的特征:如:HI分解反應,若反應在503K進行,無催化劑時,活化能是184kJmol-1,以Au粉為催化劑時,活化能降低至104.6kJmol-1
10、。由于活化能降低約80kJmol-1,致使反應速度增大約1千萬倍。 酶酶 enzyme 酶作為一種特殊的生物催化劑,酶作為一種特殊的生物催化劑,除上述特點外,還具有以下特異性:除上述特點外,還具有以下特異性: 1)催化效率高)催化效率高 2)反應條件溫和)反應條件溫和 3)高度選擇性)高度選擇性 在一定條件下,既能正向進行又能逆向進行的化學反應叫可逆反應可逆反應。通常用可逆符號代替方程式中的等號來表示可逆反應。 2HI(g) = H2(g) + I2(g); 可逆反應 為什么有些反應好象不表現出可逆性?一是逆反應傾向比較弱,二是有些反應在進行時逆反應發生的條件尚未具備,反應物即已耗盡。 3.3
11、 3.3 化學平衡化學平衡u uu u逆逆u u正正tu u正正= =u u逆逆3.3.1 3.3.1 化學平衡的特征化學平衡的特征“動、定、變動、定、變”(1)(1)動動: : 動態平衡,反應沒有停止,仍在進行,只是動態平衡,反應沒有停止,仍在進行,只是 V V正正=V=V逆,逆,對于任一反應物質而言,消耗的分子數等于對于任一反應物質而言,消耗的分子數等于生成的分子數。生成的分子數。(2)(2)定:定:反應混合物中,各物質組成含量固定,即濃反應混合物中,各物質組成含量固定,即濃度不變。度不變。(3)(3)變:變:有條件的平衡,一種外界條件對應一種平衡,有條件的平衡,一種外界條件對應一種平衡,
12、外界條件發生變化時,平衡移動。外界條件發生變化時,平衡移動。 例如:硫酸鋇的沉淀反應,基本上是向一個方向進行,其逆反應覺察不到: Ba2+SO42- BaSO4 再如:氯酸鉀的分解反應,在分解過程中逆反應的條件還不具備,反應物就已耗盡:2KClO3 = 2KCl+3O2MnO2 象這些反應實際上只能向一個方向進行到底的反應稱為不可逆反應不可逆反應。3.3.2 化學平衡常數化學平衡常數 1、化學平衡常數、化學平衡常數)()()()(BcAcEcDcKcbaed實驗平衡常數實驗平衡常數對于一般反應 a A +Bb =dD+eE 濃度平衡常數濃度平衡常數 C平衡濃度平衡濃度壓力平衡常數(氣體)壓力平
13、衡常數(氣體))()()()(BpApEpDpKpbaed p平衡分壓平衡分壓 3.3.2 標準平衡常數(熱力學平衡常數)標準平衡常數(熱力學平衡常數) 對溶液反應 a A(aq) +Bb(aq) =dD(aq) +eE(aq) baedcBccAccEccDcK)()()()(c=1moll-1對氣相反應 a A(g) +Bb( g) =dD( g) +eE( g)baedPBPPAPPEPPDPK)()()()(P=100Kpa平衡常數的意義平衡常數的意義(1)平衡常數是可逆反應的特征常數。對同類反應來說, K 越大,反應進行得越完全;(2)由平衡常數可以判斷反應是否處于平衡態和處于非平衡
14、態時反應進行的方向。3.4 化學平衡的移動化學平衡的移動 平衡移動:平衡移動:從舊的平衡狀態轉變為新的平衡狀態的過程,稱為平衡移動。 1.濃度對化學平衡的影響濃度對化學平衡的影響 對于化學反應對于化學反應 a A + b B g G + d D增大反應物濃度或減小生成物濃度時增大反應物濃度或減小生成物濃度時 , 平衡正向移動;平衡正向移動;減小反應物濃度或增大生成物濃度時減小反應物濃度或增大生成物濃度時 , 平衡逆向移動。平衡逆向移動。啟示啟示: 在化工生產中,為了充分利用某一反應物,常讓價格相對較低的另一反應物過量,以提高前者的轉化率;還可以通過從平衡系統中不斷移出生成物,使平衡向右移動,提
15、高轉化率。例如煅燒石灰石制造生石灰的反應: CaCO3(s) CaO(s)+ CO2(g) CO2不斷從窯爐中排出,提高了CaCO3的轉化率,使CaCO3完全分解。 2. 壓力對化學平衡的影響壓力對化學平衡的影響 壓力變化只對那些反應前后氣體分子數有變化的反應平衡系統有影響; 在恒溫下,增大壓力,平衡向氣體分子數減少的方向移動;減小壓力,平衡向氣體分子數增加的方向移動。 引入與反應引入與反應無關無關的氣體(如稀有氣體的氣體(如稀有氣體)等容:等容: 各組分分壓不變,不影響平衡。各組分分壓不變,不影響平衡。 等壓:等壓: 反應體系增大,組分分壓變小,平衡移向反應體系增大,組分分壓變小,平衡移向氣
16、體物質的量(分子數)增加的方向。氣體物質的量(分子數)增加的方向。 3. 溫度對化學平衡的影響溫度對化學平衡的影響對于吸熱反應對于吸熱反應: 當當T2 T1 時,平衡右移(吸熱方向)時,平衡右移(吸熱方向) T2 T1 時,平衡左移(吸熱方向)時,平衡左移(吸熱方向) T2 T1 時,平衡右移時,平衡右移 (放熱方向)(放熱方向) 溫度的變化,將使 K 改變,從而影響平衡。4. 催化劑與化學平衡 催化劑不會使平衡發生移動,但使用催化劑能降低反應的活化能,加快反應速率,縮短達到平衡的時間。由于平衡常數并不改變,因此使用催化劑并不能提高轉化率。 平衡移動原理平衡移動原理呂呂查德里原理查德里原理 如
17、果改變平衡系統中某個條件(如果改變平衡系統中某個條件(如濃度、如濃度、溫度、壓力溫度、壓力),平衡總是向著減弱這個改變的),平衡總是向著減弱這個改變的方向移動。方向移動。法國物理化學家法國物理化學家 N2(g)+3H2 (g) =2NH3 (g)3.4.4 反應速率與化學平衡的綜合應用反應速率與化學平衡的綜合應用(1)使一種價廉易得的反應物過量,以提高另一種原料的轉使一種價廉易得的反應物過量,以提高另一種原料的轉化率。化率。 例如,在例如,在SO2氧化生成氧化生成SO3的反應中,讓氧氣過量,的反應中,讓氧氣過量,使使SO2充分轉化。充分轉化。(2) 升高溫度能增大反應速率,對于吸熱反應,還能增
18、加轉升高溫度能增大反應速率,對于吸熱反應,還能增加轉化率。化率。 (3) 對于氣體反應,增加壓力會使反應速率加快,對分子數對于氣體反應,增加壓力會使反應速率加快,對分子數減少的反應還能提高轉化率。減少的反應還能提高轉化率。(4)選用催化劑時,須考慮催化劑的催化性、活化溫度、價選用催化劑時,須考慮催化劑的催化性、活化溫度、價格等,對容易中毒的催化劑需注意原料的純化。格等,對容易中毒的催化劑需注意原料的純化。 2SO2(g)+ O2(g) 2SO3(g) 為放熱的可逆反應,而且反應后氣體分子總數減少放熱的可逆反應,而且反應后氣體分子總數減少 .以下措施提高以下措施提高SO2轉化率:轉化率:(1)加大反
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 江西工程學院《儀器機械學基礎》2023-2024學年第二學期期末試卷
- 長春醫學高等專科學校《建筑信息建模技術與管理》2023-2024學年第二學期期末試卷
- 天津理工大學中環信息學院《火電廠煙氣凈化Ⅱ》2023-2024學年第二學期期末試卷
- 河北軌道運輸職業技術學院《野生動植物保護與管理》2023-2024學年第二學期期末試卷
- 西安高新科技職業學院《公共關系學》2023-2024學年第二學期期末試卷
- 大理護理職業學院《植物資源化學》2023-2024學年第二學期期末試卷
- 2024年核磁共振巖心測試儀投資申請報告代可行性研究報告
- 2024年高性能鐵氧體一次磁粉項目投資申請報告代可行性研究報告
- 安全教育說課稿
- 2025年四川瀘州自貿區龍馳商務秘書服務有限公司招聘筆試參考題庫含答案解析
- (高清版)JTG 3363-2019 公路橋涵地基與基礎設計規范
- 第10課和諧校園共同維護(課件)-【中職專用】高一思想政治《心理健康與職業生涯》(高教版2023·基礎模塊)
- 2024年04月江蘇省農業農村廳直屬事業單位2024年公開招考工作人員筆試歷年高頻考題摘選后附答案詳解
- 傷口造口進修匯報護理
- 檔案整理及數字化服務售后服務方案
- 2024年一年級《體育與健康》全冊教案
- 臂叢神經損傷康復護理
- 糜爛性胃炎的護理查房
- 【高中語文】《紅樓夢》+日常生活描寫所表現的文化內涵+統編版高中語文必修下冊
- 攝影測量與遙感課件
- 銀行安全知識培訓課件

評論
0/150
提交評論